ВЕСТНИК МОСКОВСКОГО ОНКОЛОГИЧЕСКОГО ОБЩЕСТВА
Informo, ergo sum!


Московского
Онкологического
Общества
ТЕРМИН «КАРЦИНОИД» ЕЩЕ В 2000 Г.
ЗАМЕНЕН ОПРЕДЕЛЕНИЕМ
«ЭНДОКРИННАЯ ОПУХОЛЬ»
(ЭКСПЕРТЫ ВОЗ).
ЗАМЕНА УСТАРЕВШИХ СВЕДЕНИЙ
НОВЫМИ ПРЕДСТАВЛЕНИЯМИ
УСПЕШНО ПРОДОЛЖАЕТСЯ ВПЛОТЬ
ДО НАШИХ ДНЕЙ!
| №10 (571) 2010 ОКТЯБРЬ |
ЗАСЕДАНИЕ 571
посвященное памяти академика Н.А. Краевского,
совместное с Российским обществом патологоанатомов
состоится во вторник 19 октября 2010 г. в 17:00
в конференц-зале клиники Российского онкологического
научного центра им. Н.Н. Блохина
Президиум: проф. А.И. Пачес, академик РАМН, проф. Ю.Н. Соловьев, проф. В.А. Горбунова, проф. А.И. Карселадзе
Повестка дня:
НЕЙРОЭНДОКРИННЫЕ ОПУХОЛИ.
1) МОРФОЛОГИЧЕСКАЯ И ЛАБОРАТОРНАЯ ДИАГНОСТИКА
Доклад:
МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ОСНОВНЫХ ТИПОВ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ
Делекторская В.В., Павловская А.И.
(отдел патологической анатомии опухолей человека
РОНЦ им. Н.Н. Блохина)
Доклад:
БИОХИМИЧЕСКИЕ МАРКЕРЫ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ: МЕТОДИЧЕСКИЕ И КЛИНИЧЕСКИЕ АСПЕКТЫ
Любимова Н.В., Костылева О.И., Маркович А.А.
(лаборатория биохимии РОНЦ и отделение химиотерапии НИИ КО
РОНЦ им. Н.Н. Блохина)
ЮБИЛЕИ СЕНТЯБРЯ-2010
ВЫСОКОЕ НАПРЯЖЕНИЕ ЧУВСТВ
МОСКОВСКОГО ОНКОЛОГИЧЕСКОГО ОБЩЕСТВА
В сентябре 2010 г. Московская онкологическая общественность отметила особо значимые знаменательные даты.
На специальном заседании 16 сентября, которое по существу трансформировалось в специальную научную сессию, Онкологическое общество заслушало доклады об истории, современном состоянии, научно-практических достижениях Московской онкологической больницы № 62. Эти слушания были посвящены 50-летию больницы.
Кроме того, 20 сентября Общество успешно торжествовало в связи
Атмосферу юбилейных торжеств адекватно отражают материалы С.А. Иванушкина (фотогруппа РОНЦ; т. 324-6369).

На фото: Консенсус дискуссии. (Директор РОНЦ им. Н.Н. Блохина, академик РАН и РАМН М.И. Давыдов и Главный врач Московской онкологической больницы № 62, профессор А.Н. Махсон).
Доклады, представленные 16 сентября специалистами 62-й больницы, подтвердили высокий уровень диагностики, лечения, научных исследований в этом современном многопрофильном онкологическом учреждении.

В дискуссии по докладам было подчеркнуто, что больница в различных областях лечебной практики, организации лечебного процесса, медицинской информатики не уступает достижениям ведущих отечественных научно-исследовательских центров.
Глубокий научный уровень представленных докладов был успешно дополнен последующей непринужденной, творческой дискуссией в неформальной обстановке. Правлением Общества был дан прием в честь специалистов Московской онкологической больницы № 62.

Председательствовавший 20 сентября на утренней конференции РОНЦ, академик РАМН, проф. М.Д. Алиев горячо приветствовал Председателя Московского онкологического общества, проф. А.И. Пачеса. Ответная речь 85-летнего юбиляра отличалась академизмом изложения и богатством иллюстративного материала.

Искренностью чувств были проникнуты приветствия коллег – директора НИИ онкологии Томского НЦ СО РАМН, чл.-корр. РАМН, проф. Е.Ц. Чойнзонова; зав. отд. Московского онкологического клинического диспансера, к.м.н. Н.Х. Шацкой; ведущего научного сотрудника МНИОИ им. П.А. Герцена, проф. В.О.Ольшанского; зав. кафедрой онкологии РМАПО, чл.-корр. РАМН, проф. И.В. Поддубной; зав. кафедрой челюстно-лицевой хирургии и хирургической стоматологии Северного государственного медицинского университета (Архангельск) проф. А.У. Минкина; зав. отделением опухолей головы и шеи Ростовского НИИ онкологии проф. П.В. Светицкого. Также прозвучали лаконичные слова поздравления от друзей-однополчан офицера-танкиста, кавалера 12 боевых наград Александра Ильича Пачеса.

Директор РОНЦ, академик РАН и РАМН М.И. Давыдов преподнес юбиляру жизнеутверждающий гобелен работы современного мастера искусства. Специалисты-онкологи проявили повышенный интерес к этому высокохудожественному произведению. Оно размещено в офисе Московского онкологического общества и открыто для доступа многочисленных паломников.
ТРУДЫ МОСКОВСКОГО ОНКОЛОГИЧЕСКОГО ОБЩЕСТВА
Рефераты сообщений:
PROCEEDINGS OF THE MOSCOW CANCER SOCIETY
№ 571 (October 19, 2010)
NEURO-ENDOCRINE TUMORS
(PATHOLOGY AND DIAGNOSTIC LABORATORY PROCEDURES)
Report-1: PATHOLOGY OF NEURO-ENDOCRINE TUMORS. By Prof. V. Delektorskaya, Prof. A. Pavlovskaya (The N.N. Blokhin Russian Cancer Research Center's Dept. of Pathology).
Report-2: BIOCHEMISTRY MARKERS OF NEURO-ENDOCRINE TUMORS. By Prof. N. Lubimova, Dr. O. Kostileva, Dr. A. Markovich (The N.N. Blokhin Russian Cancer Research Center's Lab. of Biochemistry and Dept. of Chemotherapy).
Доклад:
МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ОСНОВНЫХ ТИПОВ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ
Делекторская В.В., Павловская А.И.
(отдел патологической анатомии опухолей человека
РОНЦ им. Н.Н. Блохина)
Нейроэндокринные опухоли (НЭО) образуют редкую и гетерогенную группу. В литературе продолжаются дебаты о клинико-морфологических характеристиках и особенностях биологического поведения этих новообразований. Интерес специалистов к данной проблеме обусловливается и значительным увеличением (5-кратным в течение 30 лет) частоты НЭО (Yao J.C. et al. // J. Clin. Oncol. – 2008. – 26: 3063-3072).
К основным типам НЭО следует отнести эпителиальные новообразования, которые происходят из клеток диффузной эндокринной системы органов дыхания и пищеварения, способных продуцировать пептидные гормоны и биологически активные амины. Нейроэндокринные опухоли являются производными различных эмбриональных отделов первичной кишки – верхнего (foregut), из которого дифференцируются бронхи, легкие, желудок, проксимальный отдел двенадцатиперстной кишки, поджелудочная железа; среднего (midgut), предшественника дистального отдела двенадцатиперстной кишки, тощей, подвздошной, слепой и восходящей ободочной кишки, а также аппендикса; нижнего (hindgut), из которого развиваются дистальные отделы толстой кишки и прямая кишка.
Бронхопульмональные НЭО составляют до 3% всех злокачественных новообразований этой локализации и порядка 25% всех нейроэндокринных опухолей. Большая часть НЭО представлена опухолями органов желудочно-кишечного тракта включая поджелудочную железу. Эти новообразования составляют до 2% всех злокачественных новообразований пищеварительной системы и более 60% всех НЭО. Наиболее частыми локализациями в этой группе являются подвздошная кишка (17,1%), прямая кишка (16,3%), желудок (5,4%) и аппендикс (4,7%).
Встречаются также нейроэндокринные опухоли редких локализаций (производных эмбрионального нервного гребешка, нейроэктодермы и эндодермы), частота которых составляет порядка 15% всех НЭО. Потому НЭО, могут выявляться в эндокринных (феохромоцитома и параганглиома, медуллярный рак щитовидной железы, опухоли паращитовидных желез и передней доли гипофиза) и других органах (вилочковая, молочная, предстательная железы, почки, яичники, кожа).
Согласно современным представлениям, все НЭО обладают злокачественным потенциалом, но различные типы опухолей могут значительно отличаться по биологическим особенностям.
Морфологическая диагностика НЭО в РОНЦ основывается на классификации Всемирной Организации Здравоохранения, а также – на критериях оценки прогноза НЭО. Кроме того, учитываются предложения Европейского общества по изучению нейроэндокринных опухолей (ENETS, European NeuroEndocrine Tumor Society), которое разработало дополнительную систему классификации TNM и определения злокачественности НЭО желудочно-кишечного тракта и поджелудочной железы (ENETS; 2006, 2007).
ВОЗ предложена единая схема классификации для эндокринных опухолей желудочно-кишечного тракта и поджелудочной железы, которая идентифицирует три основные категории новообразований, независимо от места их развития (Solcia E., Klopel G., Sobin L. Histological typing of endocrine tumours, 2nd ed. WHO, Berlin: Springer; 2000). В классификации выделяют: 1) высокодифференцированные (нейро)эндокринные опухоли (ВД НЭО) как с «доброкачественным» биологическим поведением, так и с неопределенным потенциалом злокачественности; 2) высокодифференцированные (нейро)эндокринные карциномы низкой степени злокачественности (ВД НЭК); 3) низкодифференцированные (нейро)эндокринные карциномы высокой степени злокачественности (НД НЭК), к которым относятся крупноклеточные эндокринные и мелкоклеточные карциномы.
Кроме того, ВОЗ разработаны классификации, специфичные для конкретных анатомических локализаций, основанные на комплексе наиболее значимых прогностических факторов, к которым относятся глубина инвазии, наличие метастазов, размер первичной опухоли, инвазия кровеносных и лимфатических сосудов, нейроинвазия и митотическая активность, индекс пролиферации опухолевых клеток Ki-67 (MIB-1). Накопилось много фактов, подтверждающих неблагоприятное прогностическое значение экспрессии СК19 в НЭО поджелудочной железы, но этих данных еще недостаточно для того, чтобы рекомендовать применение данного маркера при рутинном морфологическом исследовании.
Термин «карциноид» заменен определениями «эндокринная опухоль» и «эндокринная карцинома» (для НЭО легких и бронхов термин «карциноид» сохранен как исключение). Классификация ВОЗ опухолей легких (2004) выделяет 4 основные гистологические категории НЭО данной локализации: 1) «типичный» карциноид (низкой степени злокачественности); 2) «атипичный» карциноид (промежуточной степени злокачественности); 3) крупноклеточная нейроэндокринная карцинома (КНЭК); 4) мелкоклеточный рак легкого (МРЛ). Основными прогностическими критериями, с помощью которых различают типы НЭО легкого, являются показатели митотической активности (до 2 митозов; от 2 до 10; от 10 до 70; более 70 митозов/10РПЗ) и наличие участков некроза (отсутствие некрозов, небольшие и обширные участки некрозов).
Система определения степеней злокачественности (Grade) НЭО. Европейским обществом по изучению нейроэндокринных опухолей (ENETS) в дополнение к классификации ВОЗ разработана система определения степени злокачественности НЭО (Grade, соответственно G1; G2; G3 – по количеству митозов менее 2, от 2 до 20 и более 20), а также на основе оценки уровня пролиферативной активности опухолевых клеток (индекс Ki67 (до 2, до 20 и более 20). Ключевым моментом является подсчет количества митозов в 50 полях зрения с наибольшей митотической активностью (результат выражается как среднее число митозов/10РПЗ) и определение индекса Ki-67 (клон MIB-1) как частоты окрашенных ядер при учете 2000 опухолевых клеток в областях наибольшей пролиферативной активности (рис. 1). В 2010 г. Grade утверждена Американским Объединенным Комитетом по Онкологии (AJCC). Определение индекса Ki-67 является обязательным при изучении биопсий метастазов и маленьких образцов тканей, в которых невозможен точный подсчет количества митозов (Klimstra D.S. et al.; 2010). Индекс Ki-67 является не только показателем злокачественного потенциала опухоли, который коррелирует с выживаемостью, но важным критерием в алгоритме лечения НЭО желудочнокишечного тракта (W. De Herder et al.; 2006).
Индекс Ki-67 также является важным прогностическим показателем, с помощью которого возможно различить в группе НЭО легкого «карциноиды» и НЭК высокой степени злокачественности. Однако пороговые показатели пролиферативной активности при подсчете процента Ki-67+ ядер требуют уточнения, а точная система определения степени злокачественности (Grade) на основе оценки этого показателя для НЭО легких пока не разработана.
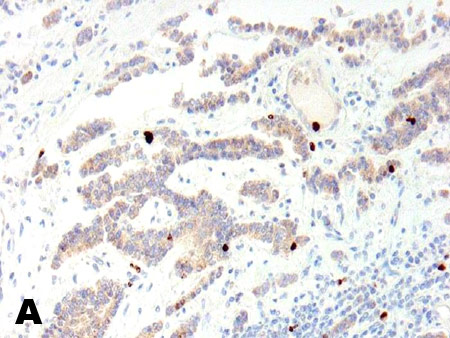
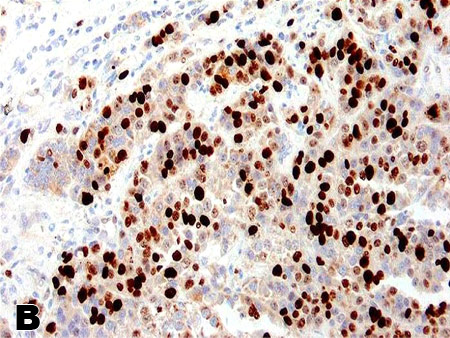
Рис. 1. Иммуногистохимическое определение индекса Ki67 (MIB-1) в НЭО поджелудочной железы. А) 1,4% меченых клеток. В) 41,0% меченых клеток.
TNM-классификации НЭО. Основными критериями, положенными в основу TNM классификаций НЭО, разработанных ENETS и AJCC, являются размеры опухоли, степень ее распространения, поражение регионарных лимфатических узлов, наличие отдаленных метастазов. Между системами ENETS и AJCC существуют незначительные различия, но основные ориентиры определения стадии аналогичны.
Нейроэндокринные опухоли пищевода. Их классификация TNM не установлена, прежде всего из-за редкости данных новообразований – они составляют примерно 0,05% всех НЭО ЖКТ. В РОНЦ наблюдались лишь 3 случая НЭО пищевода. Обычно эти опухоли имеют крупные размеры (4-10 см), локализуются в нижней трети пищевода, очень агрессивны по клиническому течению. Основными гистологическими типами являются мелко- или крупноклеточные НД НЭК.
Нейроэндокринные опухоли желудка. Эти опухоли представлены 4 типами. Тип 1 – мультифокальные, маленькие (0,5-1,0 см) высокодифференцированные новообразования, развивающиеся на фоне хронического атрофического гастрита и гипергастринемии. Это наиболее распространенные опухоли, составляющие 70-80% НЭО желудка. Течение благоприятное. В редких случаях (менее 10%) наблюдаются метастазы в регионарных лимфатических узлах, и опухоль классифицируют как ВД НЭК (рис. 2). Тип 2 – мультифокальные, размером меньше 1,5 см, развиваются на фоне множественной эндокринной неоплазии 1типа (MEN-1) с гипергастринемией и синдромом Золлингера-Эллисона. Это редкие опухоли, которые составляют <5% НЭО желудка. Тип 3 – крупные солитарные опухоли, не сопровождающиеся атрофическим гастритом, гипергастринемией или синдромом MEN-1, преимущественно ВД НЭК, имеющее агрессивное течение. Тип 4 – низкодифференцированные солидные карциномы, размером более 4 см, с обширным метастазированием, часто развиваются на фоне гипертрофии слизистой оболочки желудка.
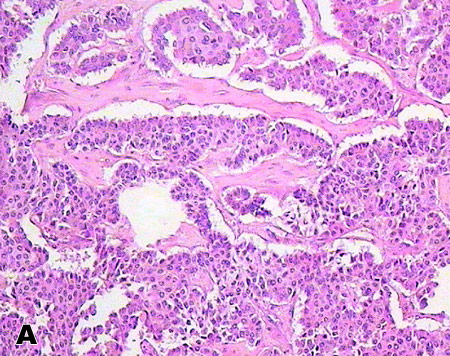
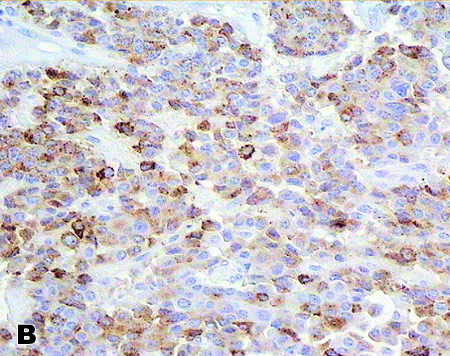
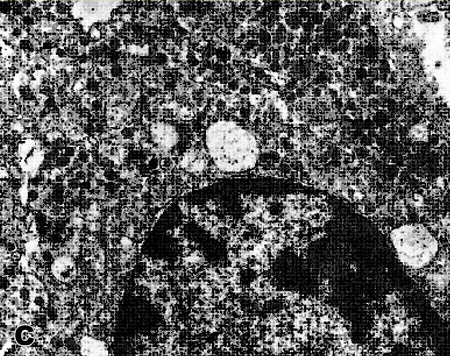
Рис. 2. Высокодифференцированные нейроэндокринные опухоли желудка 1 типа (низкой степени злокачественности) с метастазами в лимфатических узлах. А) Солидно-альвеоярные структуры опухоли. Гематоксилин и эозин (×200). В) ИГХ окраска на хомогранин А (++); (×250). Ядра клеток докрашены гематоксилином Майера. С) Электронно-микроскопическое выявление нейросекреторных гранул в цитоплазме опухолевой клетки. (×8000).
Нейроэндокринные опухоли двенадцатиперстной кишки составляют 1,8% всех НЭО ЖКТ. К ним относятся: гастрин-продуцирующие опухоли, в том числе с синдромом Золлингера-Эллисона; соматостатин-продуцирующие опухоли, в том числе с проявлениями нейрофиброматоза 1 типа; серотонин- или кальцитонин-продуцирующие опухоли; низкодифференцированные карциномы; ганглиоцитарные параганглиомы.
Нейроэндокринные опухоли тонкой кишки и аппендикса – маленькие (до 3 см), часто множественные опухоли, имеют иммунофенотип серотонин-продуцирующих EC-клеток, метастазируют в регионарные лимфатические узлы. Опухоли аппендикса, имеют размер 1-2 см и иммунофенотип серотонин-продуцирующих EC-клеток. Негативными прогностическими факторами являются размер новообразования более 1см, локализация в основании аппендикса, вовлечение прилежащих тканей и сосудистая инвазия.
Нейроэндокринные опухоли толстой и прямой кишки. Опухоли толстой кишки обычно представлены низкодифференцированными карциномами с неблагоприятным прогнозом. Часто метастазируют в регионарные лимфатические узлы и в 30% случаев – в отдаленные органы и ткани. НЭО прямой кишки составляют около 20% НЭО ЖКТ. Опухоли менее 1 см характеризуются благоприятным прогнозом, при размере более 2 см прогноз ухудшается вследствие метастазирования.
Нейроэндокринные опухоли поджелудочной железы составляют 2-10% от всех злокачественных новообразований этого органа; они могут быть одним из проявлений MEN-1. НЭО поджелудочной железы обычно представлены такими типами как инсулинома (70-75%), гастринома (20-25%) и более редкими разновидностями. Данные опухоли сопровождаются развитием гормональных синдромов, что облегчает диагностику.
Нейроэндокринные опухоли легких. В соответствии с классификацией ВОЗ к категории «карциноидов» относятся ТК и АК (НЭО низкой и промежуточной степени злокачественности). Остальные два типа опухолей относятся к категории НД НЭК высокой степени злокачественности, при этом КНЭК рассматривается как подгруппа крупноклеточных карцином, а МКРЛ является независимой нозологической единицей. В большинстве ТК установлена центральная локализация опухолей, АК в основном выявляются в периферических отделах легких.
Морфологическая диагностика первичных нейроэндокринных опухолей. Изучение особенностей терминологии, стадирования и степени злокачественности, предложенных ВОЗ, ENETS, AJCC и другими организациями, показало, что ни одна из систем классификации не может считаться универсальной. В этой связи ведущими экспертами был разработан минимальный набор универсальных данных для заключения морфолога и возможно использовать в любой из современных классификаций НЭО (Klimstra D.S. et al., 2010). Этапы морфологической диагностики НЭО включают гистологическую и ИГХ-оценку новообразования, которая проводится с учетом клинической информации. ИГХ-маркеры делятся на общие (неспецифические), определяющие нейроэндокринную природу опухолей, и специфические, выявляющие продукты секреции и конкретный тип эндокринной клетки. Кроме того, обязательно уточняется степень злокачественности с учетом пролиферативной активности опухолевых клеток (индекс Ki-67). Основными диагностическими ИГХ-маркерами, рекомендованными для практического применения, являются таковые, ассоциированные с секреторными гранулами: хромогранин А (СgА) – один из наиболее характерных неспецифических маркеров нейроэндокринной дифференцировки, связанный с плотными эндокринными гранулами (LDCV) и синаптофизин (Syn) – маркер мелких везикул с нейротрансмиттерами (SLMV). Остальные маркеры, такие как CD56 (N-CAM), PGP9,5 и особенно NSE, обладают высокой чувствительностью, но не являются достаточно специфичными и не рекомендованы для рутинного использования в диагностике НЭО. В последнее время изучают новые антигены, которые являются эффективными нейроэндокринными маркерами: VMAT1 и VMAT2, NESP55, SV2.
Электронно-микроскопическое исследование проводится только в самых сложных диагностических случаях, чаще при исследовании низкодифференцированных опухолей и основано на выявлении в цитоплазме клеток LDCV. Учитывая успехи таргетной терапии НЭО, считается перспективным исследование ряда маркеров, характеризующих чувствительность опухоли к специфическому лечению: таких как рецепторы соматостатина SSTR I-V типов, тимидилат синтетаза (ТS), факторы ангиогенеза (VEGF-r), IGF-1, pmTOR, MGMT (Volante M. et al., 2007; Ceppi P. et al., 2008.; Shida T, et al., 2009).
Морфологическая диагностика метастатических нейроэндокринных опухолей. Морфологическая диагностика биопсий печени и послеоперационного материала позволяет подтвердить диагноз, а также оценить прогноз и возможности лекарственной терапии метастатических форм НЭО. Ключевая роль в этом процессе отводится ИГХ-исследованию (рис. 3). По результатам обследования 83 пациентов, наблюдавшихся в РОНЦ в 2008-2010 гг. в связи с метастазами НЭО в печень, в 39 случаях (47,0%) была диагностирована первичная опухоль в органах ЖКТ, поджелудочной железе, бронхах и легких. Первичные опухоли были также локализованы в поджелудочной железе (12%), тонкой (9,6%), толстой и прямой кишке (по 4,8%), в желудке и аппендиксе (по 2,4%), в легких и бронхах (6,0%). Кроме того, выявлены единичные случаи метастатических НЭО редких первичных локализаций, таких как почки, яичники, молочные железы (1-2%). При этом вторичные опухолевые очаги в печени в 16,9% уже определялись при выявлении первичной опухоли. Диагностика места первичного возникновения НЭО в процессе морфологического исследования метастазов часто вызывает значительные сложности у морфолога и основывается, главным образом, на ИГХ-методах идентифицикации вероятного источника метастазирования. Два основных ИГХ-маркера рекомендованы с диагностической целью при исследовании метастазов высокодифференцированных НЭО без выявленного первичного очага: CDX2 и TTF1.
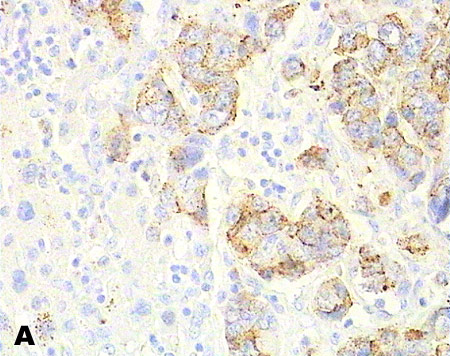
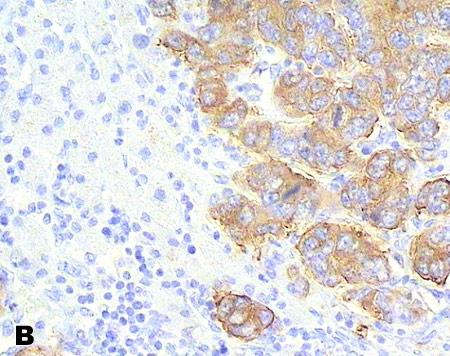
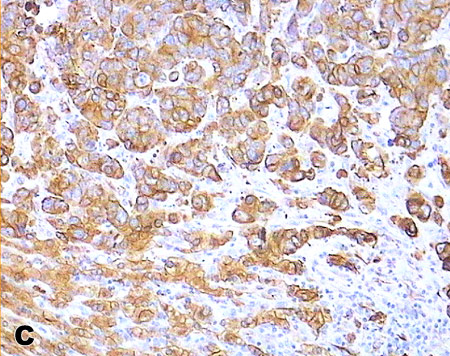
Рис. 3. Экспрессия иммуногистохимических маркеров в клетках метастазов высокодифференцированной НЭО тонкой кишки в печени: А). Хромогранин А (++); (×400). В). Синанаптофизин (+++); (×400). С). Цитокератин 18 (+++) (×250). Ядра клеток докрашены гематоксилином Майера.
Доклад:
БИОХИМИЧЕСКИЕ МАРКЕРЫ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ: МЕТОДИЧЕСКИЕ И КЛИНИЧЕСКИЕ АСПЕКТЫ
Любимова Н.В., Костылева О.И., Маркович А.А.
(лаборатория биохимии РОНЦ и отделение химиотерапии НИИ КО
РОНЦ им. Н.Н. Блохина)
Верификация нейроэндокринной структуры опухолей, как правило, достигается при помощи комплексного морфологического анализа, однако диагностика и последующий мониторинг эффективности лечения НЭО может быть эффективно проведен определением циркулирующих маркеров при биохимических исследованиях крови и мочи.
Секреторные свойства НЭО были подтверждены еще в 1950-х гг. при исследованиях сыворотки крови и мочи больных карциноидным синдромом. Выделение серотонина (промежуточного метаболита триптофана) из карциноидной опухоли в конечном итоге привело к пониманию того, что этот биогенный амин и конечный продукт его метаболизма – экскретируемая с мочой 5-оксииндолилуксусная кислота (5-ОИУК), связаны с проявлениями карциноидной симптоматики.
Поэтому серотонин и 5-ОИУК нашли применение в качестве основных маркеров НЭО. Дальнейшее изучение пептидных гормонов и биогенных аминов, секретируемых нейроэндокринными клетками, способствовало совершенствованию методов лабораторного анализа, появлению многочисленных панелей антител для иммунохимической диагностики НЭО. Современный перечень биохимических маркеров НЭО включает более 30 различных показателей. Эти маркеры являются как общими (универсальными), так и специфическими. Общими считаются биохимические маркеры сыворотки или плазмы крови – хромогранин А (ХгА), панкреатический полипептид (ПП), НСЕ, α-субъединица гликопротеиновых гормонов. Специфическими маркерами, определяемыми в сыворотке или плазме крови, являются серотонин, гастрин, инсулин, глюкагон, вазоинтестинальный пептид (ВИП), соматостатин, кальцитонин, гистамин, катехоламины, тахикинины, нейропептиды; маркерами, определяемыми в (суточной) моче являются 5-ОИУК, метанефрин, норметанефрин.
Необходимо отметить особое место ХгА в группе общих маркеров, который обладает, в отличие от других маркеров, наилучшим сочетанием диагностической чувствительности и специфичности. ХгА относится к большому семейству растворимых высокомолекулярных белков, экспрессируемых нейроэндокринными клетками, а также нейронами центральной и периферической нервной системы и белков, ассоциированных с процессом клеточной секреции. В соответствии с рекомендациями Европейского общества по нейроэндокринным опухолям (ENETS), ХгА является обязательным маркером биохимического обследования в целях диагностики, мониторинга и прогноза НЭО. ХгА характеризуется высокой диагностической чувствительностью при НЭО желудка (95%), подвздошной кишки (80%), синдроме множественных эндокринных неоплазий (78%), бронхо-легочной системы (70%), при этом в различных исследованиях была выявлена зависимость ХгА от распространенности процесса. По данным лаборатории клинической биохимии РОНЦ при обследовании 55 больных гастроэнтеропанкреатическими НЭО, получавших лечение в отделении химиотерапии РОНЦ с 2008 по 2010 гг., секреция ХгА коррелирует с биологической активностью и распространенностью этих опухолей. Наибольшая (в 100 и 220 раз) степень повышения этого гликопротеина обнаружена при НЭО тонкой кишки с проявлениями карциноидного синдрома, а также при метастазировании НЭО в печень. Важное клиническое значение определения ХгА доказано у больных опухолями поджелудочной железы: в 72% случаев, при отсутствии клинической симптоматики, наблюдалось умеренное или выраженное повышение секреции ХгА как независимого маркера диагностики и мониторинга НЭО.
Повышение эффективности биохимической диагностики НЭО может быть достигнуто при расширении спектра исследуемых маркеров, как общих, так и специфических, в соответствии с опухолевой локализацией и клинической картиной. Важными маркерами для оценки биологической активности НЭО и карциноидного синдрома остаются серотонин и его метаболит – 5-ОИУК. В клинической практике в качестве маркера карциноидных опухолей наиболее информативно исследование 5-ОИУК, чья суточная экскреция более стабильна и менее подвержена вариабельности, чем концентрация серотонина в периферической крови (поскольку на уровень 5-ОИУК в существенно меньшей степени влияют индивидуальные особенности больных, их суточные биоритмы и психологическое состояние при взятии крови). При наличии карциноидного синдрома и нормальной экскреции 5-ОИУК (что может наблюдаться в результате нарушения метаболизма биогенного амина при некоторых типах НЭО) особую значимость приобретает исследование серотонина в сыворотке крови.
По результатам лаборатории клинической биохимии РОНЦ у 65% больных при повышенном уровне серотонина в сыворотке крови наблюдается координированное увеличение экскреции 5-ОИУК суточной мочи, хотя существуют и исключения из данного правила. Как правило, расхождения показателей связаны с индивидуальными особенностями метаболизма серотонина, поскольку воспроизводились при проведении серийных исследований в целях мониторинга заболевания.
Учитывая присущую НЭО способность продуцировать биологически активные соединения, наличие клинической картины, характерной для эктопической или эутопической продукции биологически активных пептидов, а также иммуногистохимическое выявление экспрессии одного из специфических пептидов, являются основанием для дополнительного исследования секреции соответствующего маркера в крови.
При гастроэнтеропанкреатических опухолях перечень таких маркеров достаточно широк и включает гастрин, глюкагон, инсулин, проинсулин, С-пептид, панкреатический полипептид (ПП), вазоактивный интестинальный пептид (ВИП), соматостатин, гистамин и некоторые другие гормоны. Спектр биохимических маркеров расширяется определением при НЭО легких и средостения НСЕ, кальцитонина, гистамина, паратиреоидного гормона (ПТГ), СТГ и АКТГ; при феохромоцитоме – основных катехоламинов (адреналина и норадреналина в крови или моче) и их метаболитов (экскреция с мочой нор- и метанефринов). Биохимические маркеры нашли применение при опухолях гипофиза – определение пролактина, ЛГ, ФСГ, тестостерона (у мужчин), эстрадиола (у женщин), при НЭО щитовидной железы – определение калцитонина, ТТГ, Т3 и Т4; при АКТГ-эктопическом синдроме – определение АКТГ и кортизола. При некоторых локализациях НЭО требуется также определение других гормонов и нейропептидов.
В 2000-х гг. существенно расширились возможности определения маркеров НЭО, что связано с разработкой тест-систем на основе высокоспецифичных МКА. Следует отметить, что применяемые антитела обладают разной аналитической чувствительностью. На результаты определения маркеров НЭО могут также влиять различные эндогенные и экзогенные факторы.
Необходимо учитывать, что биохимическое обследование больных опухолями нейроэндокринной природы требует соблюдения методических условий взятия крови и сбора мочи, а также проведения специальной подготовки в соответствии с особенностями метаболизма и экскреции определяемых маркеров (по крайней мере за 24 часа до исследования). Одним из главных условий достоверности результата исследования является взятие крови в утренние часы, натощак, при отсутствии стрессовых факторов. Для повышения точности результатов исследований и их интерпретации важно учитывать, что причиной повышения уровня некоторых маркеров может оказаться состояние функции почек, печени, сердечно-сосудистой системы. Так, существенное влияние на показатели 5-ОИУК и серотонина может оказать употребление в пищу богатых триптофаном продуктов (бананы, авокадо, сливы, ананасы, баклажаны, помидоры, грецкие орехи, шоколад, кофе), в связи с чем пациентам следует воздерживаться от их употребления в течение трех суток до начала исследования. На уровень 5-ОИУК влияют также некоторые лекарственные препараты. При этом повышение концентрации маркера могут вызвать парацетамол, кофеин, фенацетин, резерпин, цисплатин, фторурацил, мелфалан, гваяколовый эфир глицерина (составляющее сиропов от кашля), препараты на основе раувольфии. В то же время аспирин, леводопа, метилдопа, ингибиторы моноаминоксидазы, фенотиазины, трициклические антидепрессанты, кортикотропин, хлорпромазин, гепарин, имипрамид, октреотид могут привести к обратному (заниженному) результату. При назначении исследования 5-ОИУК следует по возможности воздерживаться от применения указанных выше препаратов. Существуют также ограничения при определении ХгА, концентрация которого в плазме крови может повышаться на фоне приема препаратов, снижающих кислотность желудочного сока (ингибиторы протонной помпы, антагонисты Н2-рецепторов гистамина), которые следует отменять за 10-14 дней до анализа.
Кроме того, большинство маркеров НЭО нестабильны и требуют соблюдения особых условий обработки биологического материала. В частности, при исследовании таких пептидов, как соматостатин, ПП, ВИП требуется взятия крови с добавлением протеазного ингибитора апротинина.
В каждом конкретном случае перед взятием крови необходимо проконсультироваться в лаборатории, где будет проводиться анализ. В целом методики определения биохимических маркеров более трудоемки и сложны, чем стандартные ИФА-исследования, поэтому такие работы должны выполняться в лабораториях специализированных онкологических учреждений.




