Ультразвуковая абляция
(лечение высокоэнергетическим фокусированным ультразвуком – HIFU)
– безопасный и эффективный метод лечения гепатокарцином, располагающихся рядом с крупными сосудами
Zhang L, Zhu H, Jin Ch, Zhou K, Li L, Su H, Chen W, Bai J, Wang Zh
Медицинский университет г.Чунцин (КНР)
[High-intensity focused ultrasound (HIFU): effective and safe therapy
for hepatocellular carcinoma adjacent to major hepatic veins.
Eur Radiol. 2009 Feb;19(2):437-45]
Перевод и комментарии А.Н. Хитровой
Резюме
В Китае гепатокарционома – часто встречающаяся опухоль. Для лечения этой опухоли, с целью локального контроля опухолевого роста и увеличения долгосрочной выживаемости пациентов, используются радиочастотная абляция, чрескожная абляция этанолом, криоабляция, микроволновая абляция, лазерная интерстициальная абляция. Ультразвуковая абляция может применяться в тех случаях, когда применение всех других методов затруднительно или невозможно.
Предварительные результаты клинического использования ультразвуковой абляции весьма вдохновляют клиницистов. Целью данного исследования является определение эффективности ультразвуковой абляции опухоли, расположенной рядом с магистральными сосудами, и оценка безопасности ультразвукового воздействия на сосудистую стенку. Ультразвуковой абляции подвергались опухоли, расположенные рядом с нижней полой веной, печеночными венами, портальной веной или ее основными ветвями.
Расстояние между опухолью и сосудистыми стволами во всех случаях было менее 1 см. В 7-летнее исследование были включены 39 пациентов с 42 опухолями. Среднее значение максимального диаметра опухоли составило 7.4±4.3 (1.5–22) см. Для контроля эффективности абляции, оценки перфузии опухоли и визуализации магистральных сосудов использовалась МРТ с контрастным усилением. Из 39 пациентов 23 пациента были лицами мужского пола, 16 – женского.
Средний возраст пациентов составил 53.2 года (25–77 года). Тридцать семь пациентов имели солитарные узлы, у одного пациента было пролечено два узла, у одного пациента – три узла гепатокарциномы. 19 опухолевых узлов располагались в правой доле печени, 18 – в левой доле печени, 5 опухолей выявлялись сразу в обеих долях. Из 42 пролеченных опухолей 25 опухолей прилежали к одному сосудистому стволу, 12 – к двум, 2 – сразу к трем, одна опухоль – к 4 сосудистым структурам.
Полная абляция за один сеанс HIFU была получена в 21 случае из 42. В остальных случаях за один сеанс была достигнута более чем 50% абляция. За период наблюдения с медианой 23.8±17.2 мес. не наблюдалось ни одного случая повреждения магистрального сосуда. Удалось добиться полной абляции в тех случаях, когда опухоль располагалась близко к печеночным венам. Результаты краткосрочного и долгосрочного наблюдения подтверждают полную безопасность ультразвуковой абляции опухолей, расположенных рядом с магистральными сосудами.
Ключевые слова: HIFU – воздействие высокоэнергетическим фокусированным ультразвуком, гепатокарцинома, повреждение сосудистой стенки.
Введение
Гепатокарцинома является одной из наиболее распространенных злокачественных опухолей в Китае. Хирургическое вмешательство - стандарт лечения, в ряде случаев дающий шанс полного излечения [1,2]. Радиочастотная абляция, чрескожная абляция этанолом, криоабляция, микроволновая абляция, лазерная интерстициальная абляция также используются для локального контроля опухолевого роста и увеличения долгосрочной выживаемости пациентов.
Тем не менее, при расположении опухоли в непосредственной близости к магистральным сосудам использование данных методов часто невозможно. Кроме того, кровоток в воротной вене может быть причиной сохранения жизнеспособности рядом расположенных опухолевых клеток [3,4]. Ультразвуковая абляция (воздействие высокоэнергетическим фокусированным ультразвуком – HIFU) является новейшей неинвазивной технологией абляции, вызывающей коагуляционный некроз в точно заданной точке организма без повреждения здоровых прилежащих тканей и структур, располагающихся по ходу ультразвуковой волны [5-7].
Наведение и контроль лечения осуществляется с помощью ультразвукового исследования в реальном времени. Феномен локальной ультразвуковой термической абляции в качестве лечебного средства впервые был описан Lynn et al. [5]. Еще в 40-е годы прошлого столетия были проведены первые эксперименты на головном мозге кошек [6], однако метод не получил широкого распространения из-за отсутствия надежных средств визуализации и наведения.
Появление более совершенных средств визуализации возродило интерес к методу ультразвуковой абляции. Недавно Wu et al. сообщили о крупных зонах коагуляционного некроза, вызванных воздействием HIFU при лечении гепатокарцином [7, 8]. Можно ли использовать ультразвуковую абляцию в тех случаях, когда другие методы локального лечения не применимы?
Целью данного исследования является определение эффективности ультразвуковой абляции с целью получения некротических изменений в опухоли, расположенной рядом с магистральными сосудами, и оценка безопасности ультразвукового воздействия на сосудистую стенку.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты
Исследование одобрено этическим комитетом Медицинского Университета г. Чунцин (КНР). Исследование проводилось с января 2000 г. по декабрь 2006 г. в группе из 39 человек с циррозом печени (23 лиц мужского пола и 16 лиц – женского пола), средний возраст - 53,2 года (25-77 лет). В силу специфической локализации опухоли проведение резекции печени, радиочастотной абляции, этаноловой абляции было признано невозможным.
Из 39 пациентов перед HIFU 1 пациенту была проведена радиочастотная аблация, 18 - транкатетерная артериальная химиоэмболизация. В этих случаях резидуальная опухоль по данным КТ или МРТ вплотную прилежала к крупным сосудам. Ультразвуковая абляция проводилась через 1-2 недели после РЧА или транскатетерной артериальной химиоэмболизации.
Главной задачей исследования стало определение возможностей HIFU в локальном контроле опухолевого роста, а также безопасности воздействия на сосудистую стенку, потенциальной возможности ее повреждения. Еще одной задачей исследования стало определение выживаемости пациентов. Основным критерием включения пациента в группу исследования являлось наличие опухоли, расположенной на расстоянии, не превышающем 1 см от магистральных сосудов (нижней полой вены, печеночных вен, воротной вены и ее основных ветвей).
Критерии исключения:
- цирроз печени класса С по Чайлду – Пью;
- диффузная гепатокарцинома;
- опухолевый тромбоз воротной вены или ее ветвей;
- протромбиновый индекс менее 50%;
- число тромбоцитов менее 50 тысяч;
- число очагов более трех.
У 37 пациентов гепатокарцинома была представлена одиночным узлом, у одного пациента определялось два узла и у одного – три очага. В соответствии с классификацией TNM у 16 пациентов определялась II стадия, у 12 пациентов – III стадия, у 11 пациентов – IV ст. Диаметр опухоли определялся по максимальному размеру при КТ или МРТ.
Число опухолевых очагов определялось с помощью ультразвука, по данным ангиографии или МРТ. Для выявления опухолевой инвазии сосудов использовалось цветовое доплеровское картирование. Характеристики исследуемой группы пациентов представлены в таблице 1. Перед включением пациента в группу исследования им подписывалось обязательное информированное согласие.
Подготовка к лечению
Стандартные биохимические тесты с определением функции печени, определение протромбинового времени, развернутый клинический анализ крови, рентгенография органов грудной клетки, ультразвуковое исследование органов брюшной полости, ЭКГ, ФВД, КТ или МРТ с контрастным усилением проводились трижды в течение исследования.
Таблица 1. Основные характеристики исследуемой группы пациентов
с гепатокарциномой, расположенной у магистральных сосудов.
| Число пациентов | 39 |
|---|---|
| Пол (мужчины/женщины) | 23/16 |
| Возраст (среднее ± σ) (годы) | 53.2±12.3 |
| Размер опухоли (среднее ± σ) (см) | 7.36±4.25 |
| Число опухолевых очагов (1/2/3) | 37/1/1 |
| Количество пролеченных опухолей | 47 |
| Альфа-фетопротеин (+/-) | 24/15 |
| Вирусный гепатит В (+/-) | 20/19 |
| Класс по Чайлд-Пью ( А/B/C) | 39/0/0 |
| Стадия (TNM) (II/III/IV) | 16/12/11 |
Процедура ультразвуковой абляции (HIFU)
Ультразвуковая абляция проводилась с помощью системы JC HIFU [Chongqing Haifu (HIFU) Tech Co., Ltd., Chongqing, China] под ультразвуковым контролем в реальном времени. Использовалась ультразвуковая система A DU3 (Esaote, Genova, Italy) с диагностическим датчиком 2.5-3.5-MHz, расположенным внутри лечебной линзы. Лечебная линза диаметром 15 см, фокусное расстояние линзы - 15 см, частота излучения 0.8 МГц.
Ультразвуковая абляция осуществлялась под общей или эпидуральной анестезией, прежде всего, с целью иммобилизации, а также обезболивания пациента. Общий наркоз проводился с применением эндотрахеальной интубации, что давало возможность фиксировать фазу вдоха или выдоха при лечении опухолей, расположенных за ребрами через межреберные промежутки для лучшей визуализации опухоли. После начала наркоза пациент укладывался в необходимое для лечения положение (на живот или на правый бок) таким образом, чтобы кожа пациента контактировала с дегазированной водой.
Лечение проводилось с ходом лучей в вертикальном направлении, срезами по 5 мм. Мощность излучения постепенно увеличивалась, до появления серошкальных изменений, перекрывающих края опухоли (Рис.1). Мощность излучения составляла 160–250 Вт. Через 2 недели после операции для определения эффективности абляции проводилось КТ – или МРТ – исследование. При выявлении в опухоли очагов накопления контраста на контрольной КТ или МРТ, через две недели после первого проводился второй сеанс HIFU. Абляция считалась полной при отсутствии в опухоли накопления контрастного препарата в раннюю и отсроченную фазы КТ и МРТ.
Оценка долгосрочных результатов опухолевой прогрессии проводилась по следующим параметрам: наличие или отсутствие локального рецидива, появления новых очагов, общая выживаемость. Наблюдение в данной группе пациентов длилось до 31 марта 2007 г. В контрольное обследование входили: исследование альфа-фетопротеина, ультразвуковое исследование, КТ или МРТ с периодичностью 1 раз в два месяца.
Диагноз локального рецидива устанавливался при выявлении очагов накопления контрастного препарата при КТ или МРТ в зоне первичной опухоли. Под дополнительными очагами понимались вновь выявленные очаги накопления не менее чем в 2-х см от первоначальной опухоли. При отсутствии противопоказаний, все появившиеся очаги гепатокарциономы пролечивались с помощью HIFU.
Статистический анализ
Все данные представлены в виде средней величины ± величина стандартного отклонения. Частота и время появления локального рецидива (Таблица 2), новых очагов гепатокарциномы, общей выживаемости оценивались по методу Каплана - Мейера, достоверность различий в группах - с помощью логарифмического рангового критерия (log-rank test).
Статистически значимым считалось значение P < 0.05. Оценивались следующие параметры: (1) уровень безрецидивной выживаемости - этот показатель определялся как время от момента проведения ультразвуковой абляции до момента выявления локального рецидива или смерти; (2) уровень общей выживаемости - до последнего дня наблюдения или смерти.
Рис. 1. Пример успешного лечения гепатокарциномы.
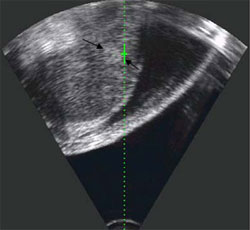
A
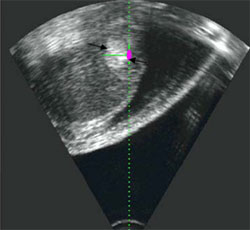
В
А. До лечения. На эхограмме в продольном срезе в начале процедуры ультразвуковой абляции стрелками отмечен небольшого размера очаг гепатокарциномы, расположенный близко к диафрагме.
Б. После ультразвуковой абляции. В продольном ультразвуковом срезе сразу после окончания ультразвуковой абляции визуализируется гиперэхогенный очаг в пролеченной зоне (черные стрелки).
Результаты
Локализация опухоли
Из 42 опухолей, 18 локализовались в левой доле (в 1-4 сегменте), 19 опухолей – в правой доле (5-8 сегменте), 5 опухолей – сразу в обеих долях. Из 42 опухолей 25 располагались около 1 магистрального сосуда, 12 – возле 2-х магистральных сосудов, 4 – возле трех и 1 опухолевый очаг – сразу возле четырех магистральных сосудов.
Все 65 магистральных сосудистых ствола исследовались в динамике. 12 сосудистых стволов были представлены нижней полой веной, 7 – правой печеночной веной, 9 - средней печеночной веной, 5 – левой печеночной веной, 18 – воротной веной, 7 – правой и 7 – левой ветвью воротной вены.
Полная абляция имела место в 39 из 42 случаев. Средний диаметр опухоли составил 7.36±4.25 cм. Тотальный некроз опухоли определялся у 21 пациента (21 опухоль из 42), т.е в 50% случаев после первого сеанса HIFU. В остальных 21 случаях произошла более чем 50% абляция (Таблица 3). Средний диаметр этих опухолей составил 9.95±4.23 cm.
Локальный рецидив или появление новых очагов
Для пациентов с полной абляцией за период наблюдения с медианой в 16.5 месяцев (среднее время 23.8±17.2 мес.) локальный рецидив (появление очага в менее чем в 2-х см от первичного очага) имел место у одного пациента из 21. Новые очаги в печени и селезенке появились у одного пациента. У 2 пациентов выявлены внепеченочные метастазы. Из четырех пациентов с рецидивом, пролеченная первичная опухоль определялась в виде одиночного узла.
Общая выживаемость
Общая выживаемость через 1, 2, 3, 4, и 5 лет составила 75.8%, 63.6%, 49.8%, 31.8% и 31.8% (Рис. 2). Из 39 пациентов 17 пациентов умерли с медианой наблюдения в 16, 5 мес. (среднее 23.8±17.2 мес). Причиной смерти у 2-х из 39 пациентов явились: прогрессирование гепатокарциномы, энцефалопатия – у 5 пациентов, кровотечение из варикозных вен пищевода – у 2-х пациентов (Таблица 4). На рис. 2 представлена кривая выживаемости пациентов с гепатокарциномой, пролеченных с помощью HIFU.
Побочные эффекты лечения
Умеренная боль отмечалась у 9 (23.1%) из 39 пациентов. Боль купировалась инъекциями или пероральным приемом анальгетиков в течение 2-3 дней. Из этих 9 пациентов с локальной болью, у 5 имелся умеренный ожог кожи, у одного пациента появились волдыри.
У 22 (56.4%) из 39 пациентов с крупными (более 5 см опухолями) в течение первых 3х дней после процедуры HIFU отмечалось 2-3–кратное повышение от исходного уровня трансаминаз. Показатели нормализовались в течение двух недель. Ни в одном случае не наблюдалось повреждения желчных протоков.
Обсуждение
Стандартными методами лечения гепатоцеллюлярного рака являются хирургическая резекция, этаноловая или радиочастотная абляция [1, 2, 9–12]. Радиочастотная и этаноловая абляция признаны эффективными для лечения небольших, менее 3-х см в диаметре, инкапсулированных гепатокарцином. Однако большинство пациентов на момент выявления имеют опухоль больших размеров. Резекция опухолей, расположенных рядом с магистральными сосудами и желчными протоками, не проводится.
Эти опухоли, вне зависимости от размера, трудно поддаются лечению с помощью радиочастотной или химической абляции, а при крупных опухолях добиться полной абляции с помощью этих методов практически невозможно (Рис.5b). Наши результаты доказывают, что возможна полная абляция опухоли, расположенной близко к сосудам, без повреждения целостности сосудистой стенки (Рис. 3, 4, 5с).
Мы не можем точно объяснить природу подобной резистентности сосудистой стенки к термическому повреждению, но наиболее вероятно, что это связано с охлаждающим эффектом быстрого уносящего энергию кровотока в крупных сосудах. Понимание факторов, влияющих на объем некроза in vivo, является залогом успешной термоабляции; в большом количестве экспериментальных работ доказано, что объем зоны некроза зависит от времени инсонации и обратно пропорционален объемному кровотоку в ткани [3,13]. Однако ранее не изучалось влияние объемного кровотока на размер некроза в печени человека при термоабляции.
Мы пролечили с помощью HIFU опухоли диаметром от 1.5 до 22 см. После первого сеанса HIFU удалось добиться 50% абляции опухоли более 5 см у 56.4% (22/39) пациентов. Несмотря на значительный объем абляции, подобный результат не может считаться удовлетворительным. По нашему мнению такой результат связан с большим объемом опухоли и охлаждающим эффектом кровотока.
В процессе усовершенствования технологии HIFU (прежде всего за счет создания лечебных линз большей энергии), по мере накопления опыта, нам удалось значительно увеличить полноту абляции таких опухолей. Время лечения подобных опухолей в будущем может быть сокращено. По данным Hori [14], локальный рецидив после одного сеанса радиочастотной абляции опухолей, диаметром более 25 мм, в течение одного года наблюдения наступал в 21,1% случаев и 32.3% после 2 лет наблюдения. При опухолях, расположенных близко к поверхности печени, в 50% случаях наступал рецидив через три года наблюдения.

Рис. 2. Кривая выживаемости Каплана-Мейера 39 пациентов после ультразвуковой абляции
с медианой наблюдения в 16.5 мес. (среднее значение 23.8±13.8 мес).
Таблица 2. Частота рецидивов гепатокарциномы у 21 пациента после 100% ультразвуковой абляции.
| Тип рецидива | Количество пациентов |
|---|---|
| Локальный рецидив | 1 |
| Рецидив в другом сегменте печени | 1 |
| Внепеченочные метастазы | 2 |
Все новые очаги выявлялись при солитарном первичном опухолевом новообразовании.
Рис. 3. Поперечный срез (КТ и МРТ) пациента (случай №1) с гепатокарциномой.
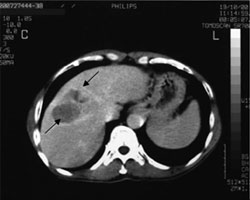
A
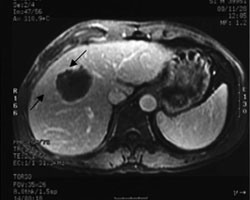
В
А. Перед HIFU. На компьютерной томограмме, выполненной в венозную фазу, визуализируется крупная опухоль (стрелки), расположенная между средней и правой печеночной веной в восьмом сегменте.
B. После HIFU. При МРТ (венозная фаза), выполненной через две недели после HIFU определяется однородное снижение сигнала и отсутствие накопление контраста в ткани опухоли (стрелки), что является свидетельством полной абляции опухоли. Кровоток по средне и правой печеночной венам не нарушен.
Таблица 3. Результаты ультразвуковой абляции 42 опухолевых очагов у 39 пациентов.
| Объем абляции (%) | Количество опухолевых очагов |
|---|---|
| 100 | 21 |
| 50-100 | 21 |
| 0-50 | 0 |
Таблица 4. Причины смерти 17 пациентов с гепатокарциномой, пролеченных с помощью HIFU.
| Причина смерти | Количество пациентов |
|---|---|
| Кровотечение из варикозных вен пищевода | 2 |
| Энцефалопатия | 5 |
| Печеночная недостаточность | 5 |
| Прогрессирование гепатокарциномы | 2 |
| Другие | 3 |
Частота локальных рецидивов в настоящем исследовании у больных, пролеченных HIFU, была ниже, несмотря на то, что объем опухолей был больше, чем в исследованиях с другими методами абляции. При радиочастотной абляции частота появления новых опухолей сопоставима или ниже.
Возможно, это связано со способностью HIFU стимулировать системный противоопухолевый иммунитет в сочетании с локальным разрушением опухоли [15]. Медиана выживаемости пациентов с нерезектабельными опухолями печени, которым не показаны другие методы лечения, включая транскатетерную артериальную эмболизацию, радиочастотную абляцию, этаноловую абляцию, составляет менее 6 мес. [16, 17].
Рис. 4. МРТ с контрастным усилением 68-летнего пациента (случай №2) с гепатокарциномой.

A
А. Перед HIFU (слева). Коронарный МРТ срез (МРТ с контрастным усилением). Визуализируется опухоль (стрелка),
расположенная между правой ветвью воротной вены и нижней полой веной.
После HIFU (справа). В пролеченной зоне нет накопления контрастного препарата (стрелка),
не определяется повреждения нижней полой и воротной вен.

B
B. Через две недели после HIFU. МРТ с контрастированием.
В пролеченной зоне накопления контраста нет (стрелка).
Повреждений окружающих сосудистых структур нет.
Не так давно, Lencioni et al. привели результаты лечения с помощью радиочастотной абляции группы пациентов с циррозом печени (класс А или В) и солитарным узлом гепатокарциномы 5 см или с множественными (до 3-х) очагами 3 см. К концу первого года наблюдения общая выживаемость составила 97%, 67% - через 3 года, 41% - через 5 лет [18].
При лечении крупных гепатокарцином часто применяется транскатетерная артериальная химиоэмболизация. Однако в рандомизированных контролируемых исследованиях не была доказана эффективность данного метода для увеличения показателей выживаемости [17, 19], хотя в небольших исследованиях приводились положительные результаты лечения [20]. Закономерен вопрос: выигрывают что-либо пациенты при проведении HIFU?
80% объемного кровотока в печени приходится на печеночную артерию, остальные 20% - на портальную вену. Поэтому после артериальной эмболизации остается жизнеспособным небольшое количество опухолевых клеток. Wu et al. убедительно доказали, что комбинация HIFU и транскатетерной артериальной эмболизации является оптимальной для лечения гепатокарциномы на поздних стадиях [21].
В более поздних работах Yamagiwa et al. [22] приводят данные об эффективности радиочастотной абляции (РЧА) после транскатетерной артериальной химиоэмболизации (ТАХЭ); общая пятилетняя выживаемость в группе пациентов с РЧА +ТАХЭ была более высокой (более 60%). Таким образом, уменьшение объемного кровотока в опухоли после ТАХЭ дает возможность снизить уровень энергии инсонации, уменьшить время лечения и, таким образом, уменьшить риск потенциальных побочных эффектов. В настоящем исследовании средний размер опухоли с неполной абляцией составил 9.95±4.23 см. Предполагается, что HIFU, выполненное после ТАХЭ, может быть более эффективным для лечения крупных опухолей.
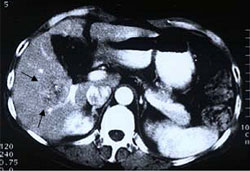
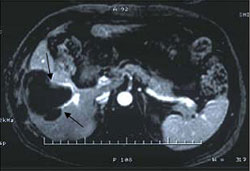
Рис. 5. Поперечный срез (КТ и МРТ с контрастным усилением) 64-летнего пациента (случай №3)
с гепатокарциномой после РЧА и последующей ультразвуковой абляцией.

A
В
C
А. До лечения. КТ в раннюю артериальную печеночную фазу. Визуализируется гиперваскулярная опухоль (стрелки), расположенная близко к правой ветви воротной вены в пятом сегменте правой доли печени.
В. После РЧА. На КТ с контрастным усилением в артериальной фазе после РЧА определяется остаточное накопление в гепатокарциноме (стрелки).
С. На МРТ с контрастным усилением, выполненном через две недели после HIFU, определяется однородное снижение сигнала (стрелки) и отсутствие накопления контраста, что свидетельствует о полной абляции. Кровоток по правой ветви воротной вены не нарушен.
В нашем исследовании средний размер опухолей был значительно больше, чем в более ранних исследованиях, поэтому в разных исследованиях достаточно сложно сравнивать уровень выживаемости. Сравнение между группами пациентов с полной абляцией и неполной абляцией показало гораздо лучшую выживаемость в группе с полной абляцией (выживаемость через 1, 3, и 5лет в группе с полной абляцией составила 86.3%, 62.3%, и 50.8% против 71.8%, 23.9%, и 0%; p<0.05 в группе с неполной абляцией).
Наиболее частой причиной смерти пациентов была печеночная недостаточность как результат прогрессирования опухолевого процесса. Однако, при хорошем локальном контроле опухолевого роста и низком уровне локальных рецидивов при ультразвуковой абляции, выживаемость значительно увеличивается.
Наши исследования показали, что HIFU – лечение также имеет низкий риск осложнений. В первые 2-3 дня пациенты жаловались на умеренную боль в области воздействия, легко купирующуюся инъекциями или пероральным приемом анальгетиков. Другим осложнением HIFU – абляции, которое наблюдалось в 12.8% случаев, был небольшой отек или ожог кожи.
В первые 2-3 дня после лечения у большинства пациентов с крупными опухолями отмечался 2-3 – кратный подъем уровня трансаминаз, однако в течение двух недель он возвращался к исходным показателям. Не отмечалось признаков кровотечения как во время процедуры, так и в последующий период наблюдения. Не было зарегистрировано случаев повреждения желчных протоков.
С появлением магнитно-резонансного наведения, в онкологическую практику был внедрен метод ультразвуковой ирургической магнитно- резонансной абляции [23]. Температурное картирование не только повышает безопасность процедуры, но также позитивно влияет на эффективность процедуры, так как позволяет оценивать температуру в зоне абляции, определять достаточность энергии воздействия для развития некроза.
Однако имеются определенные сложности при лечении гепатокарциномы или метастазов в печени с помощью МРТ наведения. Во-первых, отверстие гентри МРТ- установки относительно невелико, поэтому трудно правильно уложить пациента для лечения, особенно если опухоль локализуется в правой доле; во-вторых, трудно производить мониторинг температуры из-за движений печени во время абляции; в-третьих, процедура с МРТ достаточно дорога.
Ультразвуковое наведение проще и дешевле, поскольку нет проблем с укладкой пациентов, а также с разметкой и визуализацией опухоли и окружающих структур в реальном времени.
Наше исследование ограничено небольшим количеством наблюдений. Нам не удалось провести сравнения пациентов с изолированным HIFU и сочетанием HIFU c ТАХЭ или РЧА. Значение данного исследования лимитировано также тем, что крупный размер опухоли не был включен в критерии исключения и поэтому процент неполных абляций был достаточно высок.
В будущие исследования мы постараемся включить большое количество пациентов, более тщательно производить отбор. В нашем следующем проспективном исследовании мы планируем ввести ограничения на размер опухоли (<3 см), расположенной близко к магистральным сосудам, поэтому эффективность HIFU в лечении подобных опухолей будет оценена более точно.
По результатам настоящего исследования мы сделали вывод, что полный некроз опухоли не приводит к повреждению сосудистой стенки магистрального ствола, расположенного рядом с опухолью. В будущем, возможно, что более тщательный отбор пациентов, повторное лечение при неадекватной первичной абляции, более подробное изучение переносимости процедуры позволят лучше оценить преимущества HIFU.
СПИСОК ЛИТЕРАТУРЫ
- Makuuchi M, Kosuge T, Takayama T,Yamazaki S, Kakazu T, Miyagawa S, Kawasaki S (1993) Surgery for small liver cancers. Semin Surg Oncol 9:298–304
- Livraghi T, Makuuchi M, Buscarini L (1997) Diagnosis and treatment of hepatocellular carcinoma. Greenwich Medical Media, London
- Ng KK, Lam CM, Poon RT, Shek TW, Fan ST, Wong J (2004) Delayed portal vein thrombosis after experimental radiofrequency ablation near the mainportal vein. Br J Surg 91:632–639
- Frich L, Hol PK, Roy S, Mala T, Edwin B, Clausen OP, Gladhaug IP (2006) Experimental hepatic radiofrequency ablation using wet electrodes: electrode-to-vessel distance is a significant predictor for delayed portal vein thrombosis. Eur Radiol 16:1990–1999
- Lynn JG, Zwemer RL, Chick AJ (1942) A new method for the generation and use of focused ultrasound in experiment biology. J Gen Physiol 26:179–193
- Fry WJ, Mosberg WH Jr, Barnard JW, Fry FJ (1954) Production of focal destructive lesions in the central nervous system with ultrasound. JNeurosurg 11:471–478
- Wu F, Wang ZB, Chen WZ, Zhu H, Bai J, Zou JZ, Li KQ, Jin CB, Xie FL, Su HB (2004) Extracorporeal high intensity focused ultrasound ablation in the treatment of patients with large hepatocellular carcinoma. Ann Surg Oncol 11:1061–1069
- Wu F, Wang ZB, Chen WZ, Wang W, Gui Y, Zhang M, Zheng G, Zhou Y, Xu G, Li M, Zhang C, Ye H, Feng R (2004) Extracorporeal high intensity focused ultrasound ablation in the treatment of 1038 patients with solid carcinomas in China: an overview. Ultrason Sonochem 11:149–154
- Arii S, Yamaoka Y, Futagawa S, Inoue K, Kobayashi K, Kojiro M, Makuuchi M, Nakamura Y, Okita K, Yamada R (2000) Results of surgical and nonsurgical treatment for small-sized hepatocellular carcinomas: a retrospective and nationwide survey in Japan. The Liver Cancer Study Group of Japan. Hepatology 32:1224–1229
- Allgaier HP, Deibert P, Zuber I, Olschewski M, Blum HE (1999) Percutaneous radiofrequency interstitial thermal ablation of small hepatocellular carcinoma. Lancet 353:1676–1677
- Livraghi T, Lazzaroni S, Pellicano S, Ravasi S, Torzilli G, Vettori C (1993) Percutaneous ethanol injection of hepatic tumours: single-session therapy with general anesthesia. AJR Am J Roentgenol 161:1065–1069
- Liang HL, Yang CF, Pan HB, Lai KH,Cheng JS, Lo GH, Chen CK, Lai PH (2000) Small hepatocellular carcinoma:safety and efficacy of single high-dose percutaneous acetic acid injection for treatment. Radiology 214:769–774
- Patterson EJ, Scudamore CH, Owen DA, Nagy AG, Buczkowski AK (1998) Radiofrequency ablation of porcine liver in vivo: effects of blood flow and treatment time on lesion size. Ann Surg 227:559–565
- Hori T, Nagata K, Hasuike S, Onaga M, Motoda M,Moriuchi A, IwakiriH,Uto H, Kato J, Ido A, Hayashi K, Tsubouchi H (2003) Risk factors for the local recurrence of hepatocellular carcinoma after a single session of percutaneous radiofrequency ablation. J Gastroenterol 38:977–981
- Wu F, Wang ZB, Lu P, Xu ZL, Chen WZ, Zhu H, Jin CB (2004) Activated anti-tumourtumour immunity in cancer patients after high intensity focused ultrasound ablation. Ultrasound Med Biol 30:1217–1222
- Wingo PA, Tong T, Bolden S (1995) Cancer statistics, 1995. CA Cancer J Clin 45:8–30
- Pelletier G, Ducreux M, Gay F, Luboinski M, Hagege H, Dao T, Van Steenbergen W, Buffet C, Rougier P, Adler M, Pignon JP, Roche A (1998) Treatment of unresectable hepatocellular carcinoma with lipiodol chemoembolization: a multicenter randomized trial. Groupe CHC. J Hepatol 29:129–134
- Lencioni R, Cioni D, Crocetti L, Franchini C, Pina CD, Lera J, Bartolozzi C (2005) Early-stage hepatocellular carcinoma in patients with cirrhosis: long-term results of percutaneous image-guided radiofrequency ablation. Radiology 234:961–967
- Bruix J, Llovet JM, Castells A, Montana X, Bru C, Ayuso MC, Vilana R, Rodes J (1998) Transarterial embolization versus symptomatic treatment in patients with advanced hepatocellular carcinoma: results of a randomized, controlled trial in a single institution. Hepatology 27:1578–1583
- Takayasu K, Arii S, Ikai I, Omata M, Okita K, Ichida T, Matsuyama Y, Nakanuma Y, Kojiro M, Makuuchi M, Yamaoka Y (2006) Prospective cohort study of transarterial chemoembolization for unresectable hepatocellular carcinoma in 8510 patients. Gastroenterology 131:461–469
- Wu F, Wang ZB, Chen WZ, Zou JZ, Bai J, Zhu H, Li KQ, Jin CB, Xie FL, Su HB (2005) Advanced hepatocellular carcinoma: treatment with highintensity focused ultrasound ablation combined with transcatheter arterial embolization. Radiology 235:659–667
- Yamagiwa K, Shiraki K, Yamakado K, Mizuno S, Hori T, Yagi S, Hamada T, Iida T, Nakamura I, Fujii K, Usui M, Isaji S, Ito K, Tagawa S, Takeda K, Yokoi H, Noguchi T (2008) Survival rates according to the Cancer of the Liver Italian Program scores of 345 hepatocellular carcinoma patients after multimodality treatments during a 10-year period in a retrospective study. J Gastroenterol Hepatol 23(3):482–490 Epub 2007 Dec 13
- Kopelman D, Papa M (2007) Magnetic resonance-guided focused ultrasound surgery for the noninvasive curative ablation of tumors and palliative treatments: a review. Ann Surg Oncol 14:1540–1550
Комментарии специалиста
Хитрова Алла Николаевна, руководитель отдела ультразвуковой диагностики Медицинского центра Банка России, заслуженный врач РФ, доктор медицинских наук:
– Ультразвуковая абляция, в отличие от хирургического вмешательства, а также любых малоинвазивных методов локального воздействия, к которым относятся радиочастотная, химическая, крио-, микроволновая, лазерная интерстициальная абляция, не сопряжена с риском кровотечений, опухолевой диссеминацией, раневой инфекцией.
Данная работа представляет огромный клинический интерес, поскольку дает шанс излечения потенциально некурабельным больным, у которых опухоль интимно прилежит к крупным сосудам. Любое вмешательство в подобных случаях всегда сопряжено с очень высоким риском опасных осложнений.
По результатам настоящего исследования авторы сделали убедительный вывод, что даже полный некроз опухоли не дает повреждения сосудистой стенки магистрального ствола, расположенного рядом с опухолью.

