Внутритканевая лазерная коагуляция предстательной железы
Теодорович О.В.1, Теплов А.А.3, Андреева Ю.Ю.3, Богославский А.В.1, Борисенко Г.Г.1, Нарышкин С.А.1, Кочиев Д.Г.2
1) Российская медицинская академия последипломного образования
2) Институт общей физики им. А.М. Прохорова РАН
3) Московский научно-исследовательский онкологический институт им. П.А. Герцена, Москва, Россия
Контакты: Теплов А.А., e-mail:
Опубликовано: Журнал «Онкохирургия», 2012, том 4, №1.
Цель работы. Разработка и клиническое исследование методики разрушения злокачественной опухоли предстательной железы у больных раком предстательной железы методом внутритканевой лазерной коагуляции тканей.
Материалы и методы. С 2005 по 2010 гг. выполнены эксперименты по воздействию лазерного излучения при интерстициальной лазерной коагуляции тканей предстательной железы на 8 беспородных собаках. C учетом полученных экспериментальных данных с 2009 по 2010 гг. проведена клиническая апробация метода трансперинеальной внутритканевой лазерной коагуляции тканей предстательной железы под трансректальным ультразвуковым наведением у 30 больных раком простаты стадии T1с-2N0M0, которым в последующем выполнена позадилонная радикальная простатэктомия.
Внутритканевую лазерную коагуляцию выполняли с помощью лазерного хирургического комплекса «Лазурит» (L.Т.М. Ltd., Russia) и ультразвукового аппарата «Hawk» (B&K medical) с трансректальным датчиком. Эффективность воздействия оценивали по результатам планового гистологического исследования удаленной предстательной железы. Мощность воздействия составляла от 24 до 31 Вт, длительность воздействия в одной зоне действия лазера – от 10 до 30 сек.
Результаты. Некроз опухолевой ткани предстательной железы, подтвержденный результатами патоморфологического исследования, был достигнут при мощности лазерного излучения 31 Вт, частоте повторения импульсов 100 Гц, длительности воздействия в одном участке 30 сек. После внутритканевой лазерной коагуляции в ткани предстательной железы формируются определенные зоны изменений, имеющие вид сферы вокруг световода-излучателя: зона коагуляционного некроза, затем зона некроза и некробиоза раковых клеток, среди которых встречаются участки неповрежденных раковых клеток, и периферическая зона кровоизлияний.
Из осложнений после лазерного лечения предстательной железы отмечали дизурические расстройства в виде умеренного учащения мочеиспускания, не требующего дополнительного лечения. Дизурические явления самостоятельно регрессировали на 5-6 сутки. В динамике изменений уровня ПСА крови больных локализованным раком предстательной железы после лазерного воздействия можно отметить стойкую тенденцию к снижению показателей у 86,7±6,2% больных. После радикальной простатэктомии уровень ПСА сохранялся в пределах
Область применения результатов. Разработанный метод внутритканевой лазерной коагуляции с учетом зональности изменений после воздействия, контролируемости размеров зон повреждений ткани предстательной железы может быть использован как компонент местного малоинвазивного противоопухолевого воздействия в комплексном лечении больных раком предстательной железы.
Выводы. Получена единица объема ткани предстательной железы, подвергающаяся некрозу с последующим лизисом, в результате воздействия одной серии импульсным Nd:YAG лазером с заданными параметрами, что позволяет моделировать проведение операции под ТРУЗИ-контролем с целью разрушения опухоли.
Ключевые слова: Nd:YAG лазер, хирургический комплекс «Лазурит», внутритканевая лазерная коагуляция, локализованный рак предстательной железы.
Введение
В основе действия лазерного излучения повреждающей мощности на биологические ткани лежит поглощение соответствующими молекулами клеток фотонов лазерного излучения [16].
При внутритканевой лазерной коагуляции (ВЛК) предстательной железы происходит непосредственное воздействие введенного в ткань железы световода с диффузным аппликатором на конце. При этом энергия лазера доставляется на достаточную глубину ткани, что позволяет достичь коагуляции ткани в объеме 4-6 см3. Постепенно снижающаяся мощность и рассеивающие свойства диффузора на конце проводника препятствуют карбонизации тканей. При этом лазерный луч вызывает коагуляционный некроз с последующей атрофией в глубине ткани, не приводя к отторжению поверхностно расположенного уротелия [17].
Впервые ВЛК предстательной железы при доброкачественной гиперплазии предстательной железы была выполнена Hofstetter в 1991 году. Автор описал возможности использования неодимового (Nd:YAG), гольмиевого (Ho:YAG) и диодного лазеров [12, 13]. В 1994 году в лаборатории исследования лазерной плазмы Института общей физики им. А.М. Прохорова РАН совместно с кафедрой урологии РМАПО начались первые работы по созданию отечественного медицинского Nd:YAG-лазера. Результатом этой работы в 2001 году стал первый опытный образец лазерного хирургического комплекса «Лазурит», апробированный при лечении доброкачественных образований в урологии и мочекаменной болезни. На основании широкого внедрения лазерного излучения в клиническую практику проведены экспериментально-клинические исследования в онкоурологии у больных злокачественными опухолями предстательной железы [1].
Применение физических факторов воздействия, прежде всего, высокоэнергетического лазерного излучения в лечении рака предстательной железы в настоящее время является новаторским и малоизученным.
Предложена и клинически исследована методика разрушения злокачественной опухоли предстательной железы у больных раком предстательной железы методом ВЛК.
Материалы и методы
С 2005 по 2010 г. эксперименты по воздействию лазерного излучения при интерстициальной лазерной коагуляции тканей предстательной железы выполнены на 8 беспородных собаках, у которых in vivo изучали воздействие излучения на ткань предстательной железы. После воздействия на 3-и, 7-е, 14-е и 30-е сутки образцы ткани, подвергшейся воздействию, забирали для проведения морфометрического анализа и гистологического исследования. Во всех образцах был получен некроз ткани предстательной железы, на месте которого со временем формировалась полость от 0,5 до 1 см в диаметре.
C учетом полученных экспериментальных данных с 2009 по 2010 гг. проведена клиническая апробация метода трансперинеальной ВЛК тканей предстательной железы под трансректальным ультразвуковым наведением у 30 больных раком простаты стадии T1с-2N0M0, которым в последующем выполняли позадилонную радикальную простатэктомию. Предварительно у всех пациентов диагноз был верифицирован методом трансректальной мультифокальной биопсии (12-16-точковая биопсия).
Основной целью работы являлось определение оптимальных режимов воздействия излучения твердотельного Nd:YAG лазера в импульсно-периодическом режиме (длина волны 1064 мкм) на ткань предстательной железы и прогнозирование объемов коагулированной ткани при воздействии на опухоль. Подбор режимов ВЛК основывался на результатах экспериментального исследования и данных планового послеоперационного (после позадилонной радикальной простатэктомии) гистоморфологического изучения повреждений, вызываемых лазерным излучением в опухолевой и нормальной тканях предстательной железы.
ВЛК выполняли с помощью лазерного хирургического комплекса «Лазурит» («L.Т.М.» Ltd., Russia) (рис.1) и ультразвукового аппарата «Hawk» (B&K medical) с трансректальным датчиком.
Рис. 1. Лазерный хирургический комплекс «Лазурит».
До начала лечения больному проводили полный комплекс диагностики, включающий исследование крови на опухолевый маркер ПСА, ТРУЗИ предстательной железы и мочевого пузыря, зон регионарного метастазирования, УЗИ брюшной полости, рентгенографию органов грудной клетки, сканирование костей, многоточковую трансректальную биопсию предстательной железы с составлением топографической картины зоны забора материала из ткани предстательной железы и процентного соотношения патологических изменений, выявленных в данной зоне при морфологическом исследовании материала. На консилиуме с участием онкоуролога, врача-радиолога и анестезиолога вырабатывали план лечения больного. В исследование отбирали больных II стадии Т1с-2N0M0 рака предстательной железы, которым планировалось проведение позадилонной радикальной простатэктомии.
Методика ВЛК заключалась в следующем. Под трансректальным ультразвуковым наведением с учетом данных предварительно составленной топограммы предстательной железы по результатам первичной многоточковой биопсии выполняли пункционной иглой 18G 20 см трансперинеальную пункцию участков предстательной железы, где, по данным предварительной биопсии, был выявлен рак предстательной железы (рис.2).
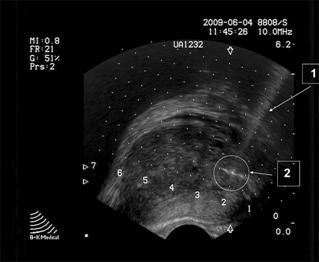
Рис. 2. Проведение пункционной иглы в ткань предстательной железы трансперинеально под ТРУЗИ контролем:
1 – УЗ-трасса иглы в ткани предстательной железы;
2 – очаг патологических изменений в ткани предстательной железы.
После извлечения мандрена по игле проводили волоконный кварцевый катетер 600 µm с прямым выводом излучения (рис.3). Затем канюлю иглы подтягивали на 5 мм для освобождения рабочей поверхности волокна в ткани железы.

Рис. 3. Волоконный кварцевый катетер.
Подбор параметров лазерного воздействия проводили с учетом результатов экспериментальных исследований. Эффективность оценивали по результатам планового гистологического исследования удаленной предстательной железы. Мощность воздействия составляла от 24 до 31 Вт, длительность воздействия в одной зоне действия лазера – от 10 до 30 сек.
В зоне воздействия лазерного излучения при ТРУЗИ-контроле в процессе проведения ВЛК наблюдали изменение эхогенности ткани предстательной железы с образованием более гиперэхогенных участков по сравнению с исходным уровнем (рис.4, 5). Контролировали интактность капсулы предстательной железы и уретры.
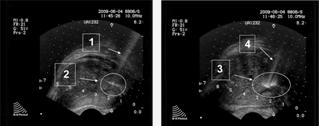
Рис. 4. УЗ-картина динамики изменений в структуре предстательной железы в момент выполнения ВЛК:
1 – УЗ трасса иглы;
2 – очаг патологических изменений предстательной железы;
3 – изменение эхогенности ткани предстательной железы при ВЛК;
4 – УЗ трасса иглы и световода.
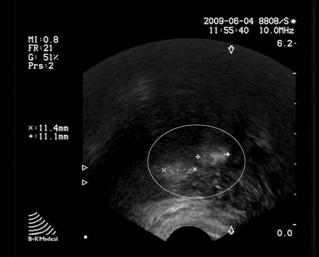
Рис. 5. УЗ-картина предстательной железы: два гиперэхогенных участка ткани предстательной железы после ВЛК.
В первой группе больных (17 пациентов) ВЛК выполняли одной серией импульсов на один пункционный доступ; во второй группе (13 пациентов) вторую серию импульсов выполняли после подтягивания канюли пункционной иглы и световода в дистальном направлении на 5 мм.
С целью изучения динамики изменений в ткани предстательной железы и опухолевой ткани простатэктомию выполняли на 6-е, 15-е и 35-е сутки.
Результаты
Некроз опухолевой ткани предстательной железы, подтвержденный результатами патоморфологического исследования, был достигнут при мощности лазерного излучения 31 Вт, частоте повторения импульсов 100 Гц, длительности воздействия в одном участке 30 сек (рис.6-8).
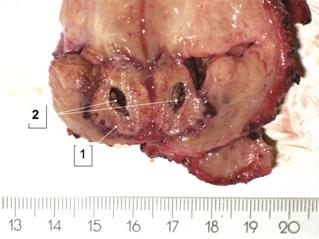
Рис. 6. Препарат предстательной железы:
1 – опухолевый узел предстательной железы;
2 – полость в зоне некроза опухоли через 35 суток после ВЛК.
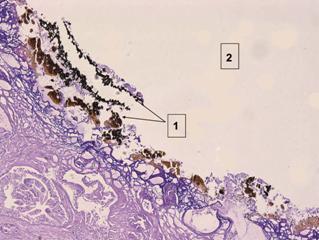
Рис. 7. Микроскопическая картина ткани предстательной железы в зоне воздействия ВЛК
(окраска гематоксилин-эозин, увеличение ×100):
1 – зона некроза; 2 – полость в центре зоны повреждения.
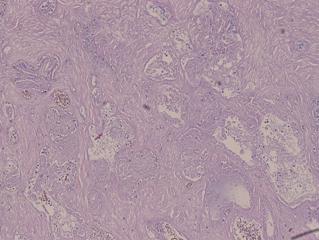
Рис. 8. Микропрепарат ткани предстательной железы в зоне ВЛК
(окраска гемотоксилин-эозин, увеличение ×100):
зона некроза и некробиоза.
При указанных выше параметрах гистологические изменения через 15 суток после воздействия выглядели следующим образом: макроскопически определяли округлый серо-коричневый участок размером от 15 до 18 мм со щелевидной полостью в центре до 5 мм, микроскопически в зоне полости – коагуляционный некроз с обугливанием краев полости; затем – мозаично расположенная зона некроза и некробиоза раковых клеток, среди которых встречались участки неповрежденных раковых клеток. Размеры данной зоны составляли от 1 до 3 мм. Следом располагалась зона кровоизлияний шириной до 5 мм.
При увеличении срока наблюдения после проведенной ВЛК до 27 суток отмечали аналогичные изменения, однако определяли увеличение размеров полости в центре воздействия до 8 мм и зоны некроза и некробиоза до 4 мм, при этом сохранялась мозаичность поражения. Зона кровоизлияния уменьшилась до 5 мм. На 35 сутки выявлено увеличение зоны некроза и некробиоза до 5,5 мм с сохранением мозаичности и дальнейшее уменьшение зоны кровоизлияний до 3 мм.
Гистологические исследования в ткани предстательной железы на сроках 1 и 6 суток после ВЛК не выявили некроза раковых клеток, что было связано с недостаточной мощностью подведенной дозы лазерного излучения на этапах подбора режима лазерного воздействия. С учетом результатов проведенного исследования можно отметить формирование определенных зон изменений в ткани предстательной железы после ВЛК, имеющих вид сферы вокруг световода-излучателя (рис.9, табл.1).
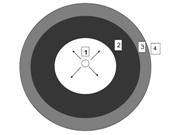
Рис. 9. Схема распределения зон изменений
в ткани предстательной железы под воздействием лазерного излучения:
1 – центральная зона (полость);
2 – зона неравномерного (мозаичного) некроза и некробиоза ткани простаты
с наличием остаточных неповрежденных структур аденокарциномы;
3 – зона кровоизлияния;
4 – зона неизмененной ткани предстательной железы.
Таблица 1. Зональность изменений в ткани предстательной железы после ВЛК.
| Зоны изменений ткани предстательной железы | Минимальные размеры зоны, мм | Максимальные размеры зоны, мм |
|---|---|---|
| 1 зона (центральная зона: полость) | 5,0±0,1 | 8,0±0,2 |
| 2 зона (зона мозаичных некрозов) | 1±0,05 | 5,5±0,1 |
| 3 зона (зона кровоизлияний) | 1,5±0,1 | 3±0,3 |
При выполнении процедуры ВЛК в отдельных наблюдениях проводили воздействие лазером со сменой положения световода. В таких случаях отмечали формирование «сигарообразной» полости в паренхиме предстательной железы (рис.10).
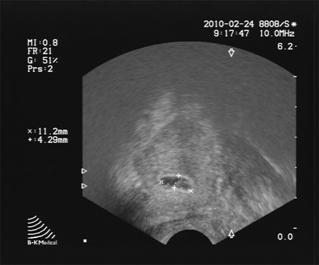
Рис. 10. Ультразвуковое исследование предстательной железы: полость в зоне лазерного воздействия.
Из осложнений после ВЛК предстательной железы отмечали дизурические расстройства в виде умеренного учащения мочеиспускания, не требующего дополнительного лечения. Дизурические явления самостоятельно регрессировали на 5-6 сутки.
Оценивая в динамике изменения уровня ПСА крови больных локализованным раком предстательной железы после ВЛК, можно отметить стойкую тенденцию к снижению показателей у 86,7±6,2% больных. После радикальной простатэктомии уровень ПСА сохранялся в пределах 0,0 нг/мл у всех больных. Медиана наблюдения составила 18 мес. (табл.2).
Таблица 2. Характер динамики уровня ПСА крови больных раком предстательной железы на фоне ВЛК и последующей простатэктомии.
| Параметры лазерного воздействия | Уровень ПСА | |||||
|---|---|---|---|---|---|---|
| Мощность 31 Вт Длительность 30 сек Суммарная доза 925 Дж |
Стартовый ПСА (до ВЛК) нг/мл |
После ВЛК (нг/мл) |
После радикальной простатэктомии (нг/мл) |
|||
| 15 суток | Более 15 суток |
3 мес. | 6 мес. | 12 мес. | ||
| 22,26 | 20,3 | 13,8 | 0,0 | 0,1 | 0,1 | |
| 17,4 | 4,8 | 4,0 | 0,0 | 0,0 | 0,0 | |
| 24,01 | 17,0 | 13,9 | 0,0 | 0,01 | 0,02 | |
| 6,8 | 0,3 | 0,2 | 0,0 | 0,0 | 0,0 | |
| 36,9 | 21,0 | 22,7 | 0,0 | 0,1 | 0,1 | |
| 5,04 | 5,3 | 8,5 | 0,0 | 0,0 | 0,0 | |
| 7,09 | 5,3 | 0,4 | 0,0 | 0,01 | 0,01 | |
| 4,7 | 3,1 | 1,5 | 0,0 | 0,0 | 0,0 | |
Выводы
Получена единица объема ткани предстательной железы, подвергающаяся некрозу с последующим лизисом, в результате воздействия одной серии импульсным Nd:YAG лазером с заданными параметрами, что позволяет моделировать проведение операции под ТРУЗИ-контролем с целью разрушения опухоли.
Разработанный метод ВЛК с учетом зональности изменений после воздействия, контролируемости размеров этих зон повреждений ткани предстательной железы может быть использован как компонент местного малоинвазивного противоопухолевого воздействия в комплексном лечении больных раком предстательной железы. Возможность применения ВЛК у больных локализованным раком предстательной железы нуждается в дальнейшем изучении.
Литература
- Теодорович О.В., Забродина Н.Б., Кочиев Д.Г. Лазерные технологии в урологии. М.: РМАПО. 2006; 4: 54.
- Ahmed H.U., Pendse D., Illing R. et al. Will focal therapy become a standard of care for men with localized prostate cancer? Nat. Clin. Pract. Oncol. 2007; 4: 632-642.
- Ahmed H.U., Emberton M. Active surveillance and radical therapy in prostate cancer: Can focal therapy offer the middle way? World. J. Urol. 2008; 26: 457-467.
- Ahmed H.U., Moore C., Emberton M. Minimally-invasive technologies in uro-oncology: The role of cryotherapy, HIFU and photodynamic therapy in whole gland and focal therapy of localized prostate cancer. Surg. Oncol. 2009; 18: 219-232.
- Ahmed H.U., Kirkham A., Arya M., et al. Is it time to consider a role for MRI before prostate biopsy. Nat. Rev. Clin. Oncol. 2009; 6: 197-206.
- Cooperberg M.R., Broering J.M., Kantoff P.W., Carroll P.R. Contemporary trends in low risk prostate cancer: Risk assessment and treatment. J. Urol. 2007; 178: 14-19.
- Crawford E.D., Wilson S.S., Torkko K.C., et al. Clinical staging of prostate cancer: A computer-simulated study of transperineal prostate biopsy. B. J. U. Int. 2005; 96: 999-1004.
- Crawford E.D., Barqawi A. Targeted focal therapy: A minimally invasive ablation technique for early prostate cancer. Oncology (Williston Park). 2007; 21: 27-34.
- De la Rosette J.J., Mouraviev V., Polascik T.J. Focal targeted therapy will be a future treatment modality for early stage prostate cancer. Eur. Urol .2009; 8(suppl): 424.
- De la Rosette J.J., Wink M.H., Mamoulakis C. et al. Optimizing prostate cancer detection: 8 versus 12-core biopsy protocol. J. Urol. 2009; 182: 1329-1336.
- Eggener S.E., Scardino P.T., Carroll P.R., et al. International task force on prostate cancer and the focal lesion paradigm. Focal therapy for localized prostate cancer: A critical appraisal of rationale and modalities. J. Urol. 2007; 178: 2260-2267.
- Hofstetter A.G., et al. Treatment of prostatic tumors with inter-stitial thermocoagulation with neodymium-YAG laser (a new treatment in minimally invasive surgery). Arch. Esp. Urol. 1993; 46(6): 317-319.
- Hofstetter A.G. Laser in urological surgery. Berlin: Springer, 1997.
- Lindner U., Weersink R.A., Haider M.A. et al. Image guided photothermal focal therapy for localized prostate cancer: Phase I trial. J. Urol. 2009; 182: 1371-1377.
- Lindner U., Laurentschuk N., Trachtenberg J. Focal laser abla-tion for localized prostate cancer. J. Endourol. 2010; 24(5): 791-797.
- Malek R.S., Barrett D.M. High power potassium-titanyl-phosphate laser vaporization prostatectomy. J. Urol. 2000; 163: 1730-1733.
- Martenson A.C. et al. Interstitial laser coagulation of the prostate. An experimental study. Br. J. Urol. 1999; 71(4): 439-444.
- Mouraviev V., Mayes J.M., Polascik T.J. Pathologic basis of focal therapy for early-stage prostate cancer. Nat. Rev. Urol. 2009; 6: 205-215.
- Onik G., Vaughan D., Lotenfoe R. et al. The «male lumpectomy»: Focal therapy for prostate cancer using cryoablation results in 48 patients with a least 2-year follow-up. Urol. Oncol. 2008; 26: 500-505.
- Onik G., Barzell W. Transperineal 3D mapping biopsy of the prostate: An essential tool in selecting patients for focal prostate cancer therapy. Urol. Oncol. 2008; 26: 506-510.
- Onik G., Miessau M., Bostwick D.G. Three-dimensional prostate mapping biopsy has a potentially significant impact on prostate cancer management. J. Clin. Oncol. 2009; 27: 4321-4326.
- Polascik T.J., Mayes J.M., Sun L., et al. Pathologic stage T2a and T2b prostate cancer in the recent prostate-specific antigen era: Implications for unilateral ablative therapy. Prostate. 2008; 68: 1380-1386.
- Polascik T.J., Mouraviev V. Focal therapy for prostate cancer. Curr. Opin. Urol. 2008; 18: 269-274.
- Polascik T.J., Mayes J.M., Schroeck F.R., et al. Patient selection for hemiablative focal therapy of prostate cancer: Variables predictive of tumor unilaterality based upon radical prostatectomy. Cancer. 2009; 115: 2104-2110.
- Rouvie`re O., Girouin N., Glas L., et al. Prostate cancer transrectal HIFU ablation: Detection of local recurrences using T2-weighted and dynamic contrast-enhanced MRI. Eur. Radiol. 2009; Aug 19. E-pub ahead of print.
- Scardino P.T. Focal therapy for prostate cancer. Nat. Rev. Urol. 2009; 6: 175.
- Schroder F.H., Hugosson J., Roobol M.J., et al. ERSPC Investigators. Screening and prostate-cancer mortality in a randomized European study. N. Engl. J. Med. 2009; 360: 1320-1328.
- Tareen B., Godoy G., Sankin A., et al. Laterality alone should not drive selection of candidates for hemi-ablative focal therapy. J. Urol. 2009; 181: 1082-1090.
- Tareen B., Godoy G., Sankin A. Can contemporary transrectal prostate biopsy accurately select candidates for hemi-ablative focal therapy of prostate cancer? B.J.U. Int. 2009; 104: 195-199.
- Turkbey B., Pinto P.A., Choyke P.L. Imaging techniques for prostate cancer: Implications for focal therapy. Nat. Rev. Urol. 2009; 6: 191-203.
- Wink M., Frauscher F., Cosgrove D., et al. Contrast-enhanced ultrasound and prostate cancer; a multicentre European research coordination project. Eur. Urol. 2008; 54: 982-992.

