Методы визуализации паращитовидных желёз
Кирпа Е.А., Решетов И.В., Голубцов А.К., Славнова Е.Н.
Московский научно-исследовательский онкологический институт им. П.А. Герцена,
Первый Московский государственный медицинский университет им. И.М. Сеченова,
Москва, Россия
Опубликовано: Журнал «Онкохирургия», 2013, том 5, №1.
В статье рассмотрена актуальность такой проблемы, как послеоперационный гипопаратиреоз, а также рассмотрены различные методы интраоперационной визуализации паращитовидных желёз как основной метод его профилактики.
Материалы и методы. Были изучены причины возникновения послеоперационного гипопаратиреоза, особенности интраоперационного определения паращитовидных желёз: варианты их расположения, отличий от окружающих тканей; методы интраоперационной визуализации паращитовидных желёз: ультразвуковой метод, сцинтиграфия, окрашивание метиленовым синим, фотодинамическая визуализация. Проведён сравнительный анализ методов, их диагностической ценности, воспроизводимости, побочных эффектов.
Результаты. Послеоперационный гипопаратиреоз – одно из серьёзных осложнений операций на щитовидной железе. Основная мера профилактики послеоперационного гипопаратиреоза – интраоперационное выявление и сохранение паращитовидных желёз. Трудность заключается в сложности определения паращитовидных желёз ad oculus. Существует несколько методов, помогающих обнаружить паращитовидные железы во время операции, у каждого есть свои достоинства и недостатки. По сравнению с УЗИ (который обладает высокой чувствительностью по отношению к аденомам паращитовидных желёз, но малоэффективен при неизменённых паращитовидных железах), радиоизотопным методом (обладающим побочным эффектом в виде лучевой нагрузки как для пациента, так и для хирурга) и окрашиванием метиленовым синим (обладающим невысокой чувствительностью) метод фотодинамической диагностики отличается высокой чувствительностью, наличием минимального количества побочных эффектов, лёгкой воспроизводимостью.
Выводы. В настоящее время разработано множество инвазивных и неинвазивных методик верификации ткани паращитовидных желёз, которые не в полной мере решают вопросы надежности диагностики. Целесообразно продолжить поиск методов комбинированной диагностики.
Ключевые слова: щитовидная железа, паращитовидная железа, послеоперационный гипопаратиреоз, интраоперационная визуализация.
Рак щитовидной железы (РЩЖ) − самая распространенная опухоль эндокринной системы. В период с 2003 по 2010 г. прирост абсолютного числа заболевших составил 28,3% у мужчин и 10,0% у женщин. Доля РЩЖ в структуре онкологической заболеваемости мужского населения стран СНГ достигла 0,5-1,0%, женского – 1,0-4,6% [11].
Основным методом лечения большинства больных с заболеваниями щитовидной железы является хирургический. После лечения у пациентов развивается первичный гипотиреоз, являющийся абсолютным показанием для проведения заместительной терапии препаратами тиреоидных гормонов [8].
Все больные, оперированные по поводу дифференцированного рака щитовидной железы, получают постоянную гормонотерапию. Обычно назначают L-тироксин. Доза L-тироксина после удаления щитовидной железы и последующего лечения радиоактивным йодом должна быть высокой – от 150 до 200 мкг/сутки. При РЩЖ гормонотерапия носит не только заместительный характер, но и является супрессивной, подавляющей продукцию тиреотропного гормона (ТТГ). Доза L-тироксина подбирается индивидуально, под контролем концентрации в крови тиреоидных гормонов и ТТГ. Супрессивная гормонотерапия подразумевает прием L-тироксина из расчета 2,5 мкг/кг и считается адекватной при уровне ТТГ 0,1 мЕд/л [7]. Нет убедительных данных, что большее подавление ТТГ (0,05 мЕд/л и ниже) улучшает прогноз. В течение года после операции супрессивную терапию назначают всем больным. Однако следует учитывать, что длительная супрессивная гормонотерапия может быть причиной медикаментозного тиреотоксикоза, и пациенты тяжело его переносят [10].
Тиреотропный гормон − фактор роста клеток папиллярного и фолликулярного рака щитовидной железы. Подавление секреции ТТГ за счет супрессивной или даже заместительной гормонотерапии уменьшает риск рецидива в тиреоидной ткани и снижает вероятность отдаленных метастазов.
В случае достижения стойкой продолжительной ремиссии без рецидива и метастазов или при наличии противопоказаний к супрессивной гормонотерапии (возраст старше 65 лет, остеопороз и заболевания сердца) проводят заместительную гормонотерапию.
Показатели компенсации при назначении гормонотерапии варьируют от 43 до 52% [5]. Адекватность гормонотерапии определяется несколькими субъективными факторами: приверженностью пациента лечению, комплаентностью между пациентом и доктором, характером и особенностями рекомендаций специалистов [4].
Неадекватная гормонотерапия, равно как и несоблюдение режима подобранного лечения, вызывает развитие гипотиреоза, значительно ухудшающего качество жизни, увеличивает риск возникновения рецидива заболевания [1].
Особое место среди осложнений хирургического лечения РЩЖ по тяжести проявления и сложности профилактики занимает послеоперационный гипопаратиреоз, который развивается при удалении или повреждении паращитовидных желёз во время оперативного вмешательства на щитовидной железе. Снижение уровня паратгормона в сыворотке крови при этом приводит к нарушению кальций-фосфорного обмена. Концентрация кальция во вне- и внутриклеточной жидкости поддерживается в очень узких пределах, что жизненно важно для нормального функционирования физиологических систем. Проведение нервного импульса, сокращение мышц и свертывание крови зависят от нормального содержания кальция. Кроме того, прочность и структура скелетной системы определяются наличием солей кальция в белковом матриксе кости. Поэтому повреждение паращитовидных желёз во время операции на щитовидной железе может привести к тяжелым проявлениям гипопаратиреоза [3].
По данным литературы, послеоперационный гипопаратиреоз, обусловленный травмой паращитовидных желёз, встречается в 1-7% после вмешательств на щитовидных железах [2, 16, 18]. Гипопаратиреоз может развиваться не только вследствие удаления образований щитовидной железы, но и в результате кровоизлияния, механического раздавливания, перевязки питающих сосудов. Поэтому так актуальна проблема визуализации паращитовидных желёз (ПЩЖ) на дооперационном этапе и, особенно, во время выполнения операции. Существующее многообразие методов дооперационного поиска ПЩЖ лишь подчеркивает их низкую информативность и специфичность.
Еще на ранних этапах развития хирургии щитовидной железы было отмечено, что у ряда больных после тиреоидэктомии появляются тонические судороги скелетной мускулатуры и в последующем развивается стойкая тетания. Сами же ПЩЖ были впервые описаны Sandström в 1880 г. и по имени открывшего их ученого были названы тельцами Сандстрёма. Их роль в организме была установлена только в 1923 г., а первая операция по удалению увеличенной ПЩЖ у пациента с фиброзным остеитом была произведена в Вене в 1925 г. Для визуализации ПЩЖ и успешного хирургического лечения необходимо знание анатомии и эмбриологии.
ПЩЖ (обычно их четыре – две верхние и две нижние) развиваются из жаберных карманов. В период внутриутробного развития происходит опускание нижних ПЩЖ из 3-го жаберного кармана, а верхних – из 4-го. Нарушения этого процесса обусловливают вариабельность локализации ПЩЖ. Верхние ПЩЖ обычно выявляются на задней поверхности доли щитовидной железы, в средней части верхних полюсов ее долей, приблизительно в 1 см над пересечением возвратного нерва и нижней щитовидной артерии. Увеличенные ПЩЖ могут опускаться кзади в трахеоэзофагеальный канал. Локализация нижних ПЩЖ более вариабельна, однако наиболее часто они расположены у нижних полюсов долей щитовидной железы. При увеличении нижние ПЩЖ могут обнаруживаться в ткани щитовидной железы или тимуса [27, 36]. В норме ПЩЖ представляют собой овальные однородные темные тельца, средние размеры которых, по данным аутопсии, составляют 5×3×1 мм, вес – 30-50 мг. При гиперпаратиреозе размеры ПЩЖ увеличиваются до 30 мм и более, а вес – от 100 до 7150 мг [20, 27, 38]. Нарушение эмбриогенеза ПЩЖ может привести к формированию добавочных или эктопированных ПЩЖ. По данным аутопсии, добавочные ПЩЖ встречаются в общей популяции в 3-5% (от 2,5 до 13%), примерно у 3% число ПЩЖ менее четырех [20, 26, 27, 38].
Ряд исследований, выполненных с целью выяснения частоты встречаемости разных мест эктопии ПЩЖ, позволил установить, что частота эктопированных ПЩЖ составляет от 15 до 45,7%. Чаще всего происходит эктопия нижних ПЩЖ, что объяснимо с точки зрения эмбриогенеза ПЩЖ. Показано, что наиболее частыми локализациями эктопии ПЩЖ являются (в порядке уменьшения): тиреоидная паренхима (33,3%), щитовидно-тимусная трубка (18,5%), тимус (14,8%), футляр сонной артерии (7,4%), верхнее средостение (7,4%), по ходу пищевода (7,4%), латерально к щитовидной железе (3,7%), позадиглоточное пространство (3,7%), по ходу возвратного нерва (3,7%) [20]. Во время оперативного вмешательства выявлено, что 3-10% всех опухолей ПЩЖ эктопировано в ткань щитовидной железы [34], а 10-15% – в область тимуса [33].
Неудачи оперативного вмешательства обычно связаны со сложностями поиска околощитовидных желез на шее и в средостении. Для повышения эффективности операций и снижения риска послеоперационного гипопаратиреоза были предложены различные методы предоперационного выявления ПЩЖ, среди которых в последние годы наибольшее признание получили неинвазивные методы топической диагностики.
Ультразвуковое исследование успешно используют для визуализации ПЩЖ с начала 80-х гг. ХХ в. Необходимо отметить, что нормальные ПЩЖ в большинстве случаев не выявляются даже при использовании современных аппаратов с высоким разрешением и датчиком 10 МГц. Это связано как с малыми размерами желез, так и с тем, что в норме структуру ПЩЖ составляют жировые клетки, фиброваскулярная строма и адипоциты. Такая структура обеспечивает ПЩЖ эхогенность, сходную с щитовидной железой [6, 12]. Характерную гипоэхогенность ПЩЖ приобретают при формировании аденомы или гиперплазии, когда количество клеток начинает преобладать над стромой и жировой тканью [27, 38].
В типичных случаях ПЩЖ сонографически представляют собой образования округлой или овальной формы, размерами менее 3 см в любом направлении, с ровными четкими контурами, гипоэхогенные, чаще однородной структуры, расположенные у задней стенки верхних и нижних полюсов щитовидной железы [38]. Почти всегда отмечается отсутствие васкуляризации, однако с увеличением размеров ПЩЖ может регистрироваться внутренний кровоток (в 32% при среднем размере желез 21×10 мм) [21]. Кальцификация является патогномоничной для образований щитовидной железы и практически отсутствует в ПЩЖ. Такая картина встречается в большинстве наблюдений (84,6%) [33].
Диагностическая точность эхографии в отношении ПЩЖ составляет 65-75% [6, 12]. Метод может быть использован и для интраоперационного определения ПЩЖ.
Для визуализации ПЩЖ широко используют сцинтиграфию. При этом существует несколько методик выполнения сцинтиграфии ПЩЖ, и до сих пор идут дебаты о том, какая из них позволяет лучше визуализировать железы. Методики сцинтиграфии ПЩЖ в первую очередь различаются используемыми радиоизотопными метками, а также могут выполняться по двухфазному протоколу с одной меткой и вычитательному протоколу с двумя метками. Принцип протокола с использованием двух меток основан на том, что в вену последовательно вводят два изотопа, и после введения каждого делают снимок. Поскольку элиминация изотопа из щитовидной и паращитовидных желез происходит с разной скоростью (медленнее из ПЩЖ), при вычитании изображения, полученного при использовании второй метки, которая накапливается только в щитовидной железе, из первого изображения получают искомое изображение гиперфункциональных ПЩЖ.
Двухфазный протокол является более простым и экономичным. Его принцип основан на том, что элиминация радиофармпрепарата из гиперфункциональной увеличенной ПЩЖ происходит медленнее, чем из нормальной тиреоидной ткани. После внутривенного введения радиофармпрепарата выполняют два снимка шеи и верхней части грудной клетки в прямой планарной проекции: через 10-15 мин. (ранняя фаза) и через 2-3 ч (отсроченная фаза). Во время ранней фазы происходит накопление радиоизотопа в тканях щитовидной железы, нормальных и измененных ПЩЖ. В отсроченную фазу накопление изотопа сохраняется только в измененных ПЩЖ, поскольку из щитовидной железы и неизмененных ПЩЖ изотоп достаточно быстро элиминируется.
Первые изотопные метки, которые использовали для визуализации ПЩЖ, были 201Tl и 99mTc-пертехнетат. Метаанализ 19 исследований, в которых применяли 201Tl-99mTc-вычитательную сцинтиграфию, показал, что данный метод позволяет визуализировать 308 из 675 измененных ПЩЖ, чувствительность метода составила 45,6% [13]. В 1989 г. было показано, что сцинтиграфия с 99mTc-methoxyisobutylisonitrile (99mTc-sestamibi) имеет большую ценность для локализации ПЩЖ, чем традиционно используемая сцинтиграфия с 201Tl-99mTc-пертехнетатом, поскольку ПЩЖ имеют большую аффинность к sestamibi в связи с высоким содержанием митохондрий и высоким уровнем аэробного клеточного метаболизма [26]. Несмотря на то, что в 1995 г. для идентификации измененных ПЩЖ была предложена сцинтиграфия с 99mTc-tetrofosmin, чувствительность которой при первичном гиперпаратиреозе составила 95% [24], а при вторичном – 80,6% [25], в настоящее время наиболее часто используют 99mTc-sestamibi. Чувствительность двухфазного протокола с sestamibi варьирует от 60 до 90% [39]. При выполнении вычитательной сцинтиграфии в качестве первой метки используют 99mTc-sestamibi, а второй – 99mTc-пертехнетат или 123I, причем предпочтительнее использовать 123I. Ряд авторов считает, что вычитательная сцинтиграфия обладает большей чувствительностью, чем двухфазный протокол. Так, показана более высокая чувствительность вычитательной сцинтиграфии по сравнению с двухфазным протоколом у пациентов с рецидивом гиперпаратиреоза [17] и у пациентов с первичным гиперпаратиреозом до хирургического лечения [23]. Однако на сегодняшний день данных, подтверждающих преимущества вычитательного протокола, недостаточно. В то же время неудобствами этого протокола, помимо необходимости введения двух меток, являются невозможность получения множественных снимков и возможные артефакты при движениях пациента, а также при вычитании одного изображения из другого [30]. Поэтому в связи с меньшей стоимостью, относительной простотой выполнения и достаточно высокой диагностической чувствительностью двухфазный протокол с 99mTc-sestamibi является наиболее популярной методикой сцинтиграфии ПЩЖ [27].
Так же, как и при УЗИ, чувствительность сцинтиграфии выше при первичном гиперпаратиреозе и зависит от размеров увеличенных желез. У пациентов с первичным гиперпаратиреозом чувствительность 123I и 99mTc-sestamibi-вычитательной сцинтиграфии составляет 94%, при вторичном гиперпаратиреозе она несколько ниже – 80%. При первичном гиперпаратиреозе максимальная диагностическая чувствительность отмечена в случае солитарной аденомы (88%); при гиперплазии и двух аденомах диагностическая чувствительность, как и при УЗИ, значительно ниже (44 и 30% соответственно) [27]. Более низкая чувствительность при вторичном гиперпаратиреозе обусловлена тем, что первично гиперплазированные ПЩЖ по размерам обычно меньше, чем аденомы. Чем больше число измененных ПЩЖ и меньше их вес, тем меньше вероятность их визуализации при сцинтиграфии [26, 31]. Так, чувствительность двухфазного протокола с sestamibi при больших ПЩЖ составляет 90%, а малых – 40,7% [26]. Васкуляризация желез, которая присутствует при аденоме, несколько повышает вероятность их сцинтиграфической визуализации [26]. Радиофармпрепарат (в частности, sestamibi) накапливается в оксифильных клетках, которые содержат много митохондрий и количество которых увеличивается при узелковой гиперплазии. Поэтому повышенный захват данного изотопа ПЩЖ позволяет предположить наличие узелковой гиперплазии [31]. При исследовании пациентов с уремией и вторичным гиперпаратиреозом показано, что чувствительность двухфазного протокола с sestamibi для визуализации узелковой гиперплазии значительно выше и составляет 76,2%, в то время как для диффузной – 28,6% [31]. Однако, несмотря на различия в визуализации ПЩЖ при аденоме и гиперплазии, точно дифференцировать различные гистологические типы увеличения ПЩЖ не представляется возможным [26, 31].
Ложноположительные результаты сцинтиграфии, как и при УЗИ, наиболее часто связаны с сопутствующим многоузловым зобом, а ложноотрицательные – с малыми размерами ПЩЖ [35, 36]. Несомненным преимуществом сцинтиграфии перед УЗИ является возможность визуализировать эктопированные ПЩЖ, включая эктопию в средостение [27]. Кроме того, результаты сцинтиграфии позволяют косвенно судить об уровне ПТГ, поскольку захват 99mTc-sestamibi пропорционален функциональной активности ПЩЖ, отражением которой является уровень ПТГ. Для оценки степени тяжести вторичного гиперпаратиреоидоза P Ambrosoni и соавт. (2003) предложен тест подавления: после однократной внутривенной инъекции 2 мкг кальцитриола при вторичном гиперпаратиреоидозе средней степени тяжести через 2 недели ПЩЖ не будут выявляться сцинтиграфически (положительный тест). При тяжелом вторичном гиперпаратиреоидозе подобного подавления функциональной активности не будет, что говорит о необходимости ПТЭ или инъекции этанола [15].
Преимуществом сонографии является возможность более точно определить анатомическую локализацию увеличенной ПЩЖ по отношению к щитовидной железе [27]. Кроме того, в случае вторичного гиперпаратиреоидоза чувствительность УЗИ одинакова как для узелковой, так и для диффузной гиперплазии, в то время как при сцинтиграфии лучше выявляется узелковая гиперплазия [31].
В 90-е гг. ХХ в. большинство исследователей сходились во мнении, что УЗИ ПЩЖ обладает меньшей чувствительностью и специфичностью, нежели сцинтиграфия, и очень редко позволяет выявить гиперплазированные ПЩЖ, которые не были визуализированы сцинтиграфически [26]. На наш взгляд, при использовании современных ультразвуковых аппаратов и наличии опытного специалиста различия в чувствительности этих двух методов могут быть нивелированы.
В ряде работ показано, что одновременное использование УЗИ и сцинтиграфии увеличивает диагностическую чувствительность до 81-98%. Поэтому большинство авторов считают, что наилучшей стратегией дооперационного определения ПЩЖ является использование обоих методов, особенно если применение одного из них не позволяет выявить ПЩЖ или размеры визуализированных ПЩЖ не соответствуют уровню ПТГ, а также в случае сопутствующей тиреоидной патологии [19, 22, 27, 35].
Однако данные методы больше подходят для выявления измененных гиперфункциональных ПЩЖ на фоне неизмененной щитовидной железы, чем для поиска неизмененных ПЩЖ при патологии щитовидной железы [9].
Также известен способ интраоперационного гамма-сканирования с радиофармпрепаратом технетрилом [32]. В предоперационном периоде пациенту вводят внутривенно технетрил, а во время операции хирург локализует ПЩЖ путем сканирования портативным стерильным гамма-датчиком. Однако данный способ не позволяет визуализировать образования щитовидной железы в 29% при первичных операциях и в 56% при повторных вмешательствах, требует дорогостоящего оборудования и сопровождается значительной лучевой нагрузкой.
Известна методика визуализации ПЩЖ с использованием внутривенной инфузии раствора метиленового синего в предоперационном периоде с развитием синего окрашивания образований щитовидной железы [28]. Однако метиленовый синий окрашивает только 46% неизмененных ПЩЖ [29]. Кроме того, известно, что его использование может приводить к развитию острых неврологических нарушений после операции [15, 37].
В качестве наиболее близкого аналога нами использован способ (описан в патенте RU 2394505 С1 от 20.07.2010), включающий фотодинамическую визуализацию ПЩЖ. Для визуализации двукратно перорально вводят раствор 5-аминолевулиновой кислоты в дозе 20 мг/кг за 180±15 мин. до начала операции и в дозе 10 мг/кг за 60±10 мин. до начала операции. Операцию проводят при облучении ткани поляризованным синим светом с использованием эндоскопа с системой фильтров для регистрации флюоресценции. По мнению авторов, указанный способ позволяет более быстро и эффективно удалить ткань щитовидной железы с сохранением функции околощитовидных желез при отсутствии осложнений, снизить травматичность операции за счет фотодинамической визуализации ПЩЖ. Однако указанный способ также не лишен ряда недостатков. Так, поскольку 5-аминолевулиновая кислота способна накапливаться в любых тканях с повышенным метаболизмом, обнаружение ПЩЖ при операциях по поводу злокачественных процессов щитовидной железы или окружающих тканей представляет определенные затруднения (хотя визуализация ПЩЖ чаще всего требуется именно при проведении вмешательств по поводу злокачественных новообразований щитовидной железы, в т.ч. сопровождающихся метастатическим поражением лимфатических узлов). Кроме того, двукратное использование 5-аминолевулиновой кислоты в целях усиления и создания более продолжительного «свечения» тканей с повышенным метаболизмом небезопасно для пациента и вряд ли способствует снижению травматичности вмешательства. Интервал между первым введением вещества и началом операции в 180 мин. является избыточным, т.к. за это время 5-аминолевулиновая кислота успевает «уйти» из ткани ПЩЖ, что затрудняет ее визуализацию, а введение фотосенсибилизатора за 60 мин. до операции недостаточно для устойчивого его накопления в тканях ПЩЖ.
По разработанной в МНИОИ методике интраоперационной флюоресцентной навигации паращитовидных желёз (патент на изобретение №2458689 от 28.03.2011) до выполнения оперативного вмешательства (как первичного, так и реоперации) у пациентов исследуют уровень гормонов щитовидной железы (ТТГ, Т4, Т3, ТГ, АТ к ТПО, паратгормона) и кальция. В день операции за 2,5-3 часа до интубации они перорально принимают препарат аласенс (из расчета 30 мг/кг). Во время операции операционное поле освещается поляризованным синим светом с помощью установки Karl Storz D-Light С. Возникающее при этом свечение ПЩЖ фиксируют с помощью эндоскопа с системой фильтров диаметром 5 мм, видеокамеры. Во время операции оценивается количество выявленных ПЩЖ, интенсивность их флюоресценции. При обнаружении флюоресцирующих участков выполняют срочное цитологическое исследование (подтверждение того, что участок – ткань паращитовидной железы) и удаляют препарат. При отсутствии онкологических противопоказаний осуществляют выделение и транспозицию (при необходимости – аутотрансплантацию) ПЩЖ (патент на изобретение №2457795 от 08.12.2010). Выполняют гистологическое исследование удаленного препарата.
В послеоперационном периоде проводят противовоспалительную, противоотечную, гормонозаместительную терапию.
Для оценки эффективности сохранения паращитовидных желёз осуществляют контроль уровня гормонов (ТТГ, ТГ, Т4, Т3, АТ к ТПО, паратгормона) и кальция на 7, 27 и 57 сутки после операции. При выполнении аутотрансплантации ПЩЖ с наложением сосудистых анастомозов на 7 сутки после операции проводят УЗДГ для оценки проходимости сосудов и кровоснабжения реваскуляризированной ПЩЖ.
Особое значение отводят цитологической диагностике паращитовидных желёз как одному из критериев эффективности их обнаружения (рис. 1, 2, 3, 4).

Рисунок 1. Цитограмма паращитовидной железы.

Рисунок 2. Цитограмма паращитовидной железы.
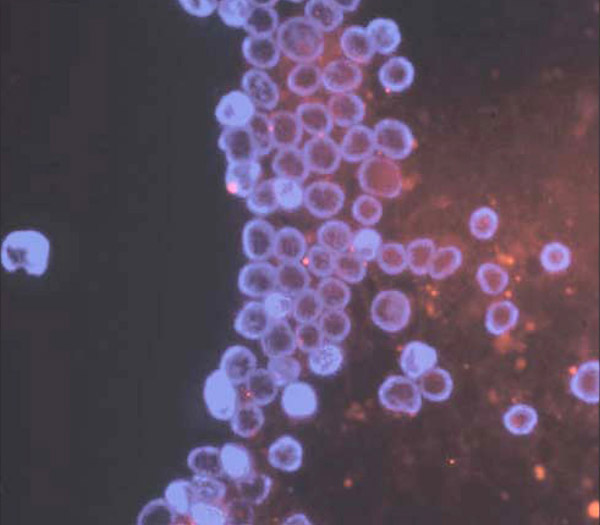
Рисунок 3. Цитограмма гиперплазированного лимфатического узла.

Рисунок 4. Цитограмма гиперплазированного лимфатического узла.
При изучении цитологических препаратов ПЩЖ, накопивших 5-аминолевулиновую кислоту, в режиме флюоресценции отмечается характерное свечение. На препарате хорошо видно, что 5-аминолевулиновая кислота накапливается в цитоплазме клеток паращитовидной железы, отдельно визуализируются ядра клеток.
В ткани паращитовидных желёз отчетливо видны светящиеся включения 5-аминолевулиновой кислоты (рис. 1, 2), в ткани гиперплазированного лимфатического узла таких включений нет (рис. 3, 4).
Преимущества методики: однократное применение препарата «Аласенс», что упрощает воспроизводимость методики; оптимизация временного промежутка между приемом препарата, что позволяет попасть в тот диагностический диапазон, когда концентрация препарата в тканях паращитовидных желёз оптимальна для выполнения исследования. Для сокращения ложноположительных результатов (при наличии метастазов рака щитовидной железы) выполняют срочное цитологическое исследование.
Заключение
В настоящее время разработано множество инвазивных и неинвазивных методик верификации ткани паращитовидных желёз. Однако анализ современной научной литературы позволяет сделать вывод о том, что существующие методы не решают вопросы надежности диагностики в полной мере. Целесообразно продолжение поиска эффективных методов комбинированной диагностики ПЩЖ.
Литература
- Берштейн Л.М., Цырлина Е.В., Крюковских (Порозова) А.А. и др. Сиофор (метформин) как модификатор тиреотропинингибирующего эффекта тироксина. Клин. экспер. тиреоидол. 2006; 2(4): 47-51.
- Брейдо И.С. Хирургическое лечение заболеваний щитовидной железы. СПб: Медицина. 1998; 336.
- Макарьин В.А., Слепцов И.В., Бубнов А.Н. и др. Видеоассистированные операции на околощитовидных железах с использованием фотодинамической визуализации – предварительные результаты клинического применения. Вестник Российской Военно-медицинской академии. 2009; 25, Прил. 1: 787.
- Мануйлова Ю.А. Медико-социальные аспекты заместительной терапии гипотиреоза: факторы, влияющие на качество компенсации: Дис. канд. мед. наук. 2009; 123.
- Мельниченко Г.А., Фадеев В.В., Дедов И.И. Заболевания щитовидной железы во время беременности: Пособие для врачей. М.: 2003; 47.
- Митьков В.В. Клиническое руководство по ультразвуковой диагностике. 2004, том 4, стр. 120.
- Радичев А.А. Радиойодтерапия дифференцированного рака щитовидной железы. Взгляд онколога-радиолога. Международный научный форум «Рак щитовидной железы. Современные принципы диагностики и лечения». СПб: 2009; 114-117.
- Решетов И.В., Ольшанский В.О., Трофимов Е.И., Голубцов А.К., Ратушный М.В. Рак щитовидной железы на фоне узловых образований. Российский онкологический журнал. 2002; 3: 7-11.
- Румянцев П.О., Ильин А.А., Боговина Ю.С., Сёмин Д.Ю., Желонкина Н.В., Двинских Н.Ю., Румянцева У.В., Шавладзе З.Н. Диагностика опухолей паращитовидных желёз на основе лучевых методов. Международный научный форум «Патология околощитовидных желез: Современные принципы диагностики и лечения». СПб: 2010; 105-108.
- Тавровская Т.В., Шатилло К.Г., Лих Н.А. и др. Впервые выявленная мерцательная аритмия: характеристика пациентов. Кардиоваскулярная терапия и профилактика 2007; 6(5), Прил. 1: 299.
- Чиссов В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2010 году. М.: 2012; 33-43.
- Эпштейн Е.В., Матящук С.И. Атлас-руководство по ультразвуковому исследованию щитовидной железы, 2004 (Глава 7. Паращитовидные железы, стр. 97).
- Adalet I, Hawkins T, Clark F, et al. Eur J Nucl Med. 1994; 21: 509-513.
- Ambrosoni P, Olaizola I, Heuguerot C, et al. Amer J Med Sci. 2000; 320: 90-95.
- Bradley KW, Cameron AJD, Rhea Liang, et al. Serotonin syndrome following methylene blue infusion during parathyroidectomy: A case report and literature review. Canad J Anest. 2008; 55: 36-41.
- Cavallaro G, Taranto G, Chiofaio MG, Cavallaro E. Usefulness of microsurgery to isolation of recurrent laryngeae nerve and parathyroid during thyroidectomy operations. Microsurgery. 1998; 18(8): 460-461.
- Chen CC, Skarulis MC, Fraker DL, et al. J Nucl Med. 1995; 36: 2186-2191.
- Flynn MB, Lyons KJ, Tarter JW, Ragsdale TL. Local complications after surgical resection for thireoid carcinoma. Amer J Surg. 1994; 168(5): 404-407.
- Fuster D, Ybarra J, Ortin J, et al. Eur J Nucl Med Mol Imaging. 2006; 33: 467-473.
- Gomes EM, Nunes RC, Lacativa PG, et al. Acta Cir Bras. 2007; 22: 105-109.
- Gooding GA, Clark OH. Am J Surg. 1992; 164: 51-56.
- Haber RS, Kim CK, Inabnet WB. Clin Endocrinol. 2002; 57: 241-249.
- Hindie E, Melliere D, Jeanguillaume C, et al. J Nucl Med. 1998; 39: 1100-1105.
- Hiromatsu Y, Ishibashi M, Nishida H, et al. Intern Med. 2000; 39: 101-106.
- Ishibashi M, Nishida H, Kumabe T, et al. Clin Nucl Med. 1995; 20: 902-905.
- Jeanguillaume C, Ureña P, Hindié E, et al. Radiology. 1998; 207: 207-213.
- Johnson NA, Tublin ME, Ogilvie JB. AJR. 2007; 188: 1706-1715.
- Klopper P, Мое RE. Demonstration of parathyroids during surgery in dog with preliminary reports of results in some clinical cases. Surgery. 1966; 59: 1101.
- Kuriloff DB, Sanbom KV. Rapid intraoperative localization of parathyroid glands utilizing methylene blue infusion. Otolaryngol Head Neck Surg. 2004; 131(5): 616-622.
- Lavely WC, Goetze S, Friedman KP, et al. J Nucl Med. 2007; 48: 1084-1089.
- Nishida H, Ishibashi M., Hiromatsu Y. Endocrinol J. 2005; 52: 223-228.
- Norman J. Minimally invasive radioguided parathyroidectomy: An endocrine surgeons perspective. J Nucl Med. 1998; 39: 15-24.
- Randel SB, Gooding GA, Clark OH, et al. Radiology. 1987; 165: 191-194.
- Solbiati L, Montali G, Croce F, et al. Radiology. 1983; 148: 793-797.
- Sukan A, Reyhan M, Aydin M, et al. Ann Nucl Med. 2008; 22: 123-131.
- Suliburk JW, Perrier ND. Oncologist. 2007; 12: 644-653.
- Sweet G, Standiford S. Methylene-blue-associated encephalopathy. J Am Coll Surg. 2007; 204(3): 454-458.
- Takebayashi S, Matsui K, Onohara Y, et al. AJR. 1987; 148: 911-914.
- Wada A, Sugihara M, Sugimura K, et al. Radiat Med. 1999; 17: 275-282.

