Принципы лечения локальных рецидивов рака молочной железы с учетом изменения иммунофенотипа первичной опухоли
Дружков М.О., Гатауллин И.Г., Дружков О.Б.
Государственное автономное учреждение здравоохранения «Республиканский клинический онкологический диспансер», Казань, Россия
В статье рассмотрены принципы лечения локальных рецидивов рака молочной железы.
Материалы и методы. Нами проведен ретроспективный анализ историй болезней больных, прошедших лечение в республиканском онкологическом диспансере за период с 2000 по 2011 гг. Отобранные 130 клинических случаев возникновения локального рецидива были проанализированы по следующим параметрам: иммуногистохимическое исследование гормональных рецепторов, опухолевого тканевого маркера HER2/neu и индекса пролиферативной активности Ki67. Полученные результаты подлежали сравнению с соответствующими показателями первичных опухолей у данных пациентов.
Результаты. По нашим наблюдениям фенотип (молекулярно-генетический подтип) рака молочной железы меняется в 31,9% случаев.
Изменения в опухолях люминального А фенотипа произошли у 10% пациентов (p<0,05). Рак молочной железы люминального В HER2-позитивного подтипа поменял иммунофенотип в рецидивных опухолях у 75% пациентов (p=0,005). Трижды-негативные опухоли поменяли иммунофенотип в 33,3% случаев. Динамика иммунофенотипа рака молочной железы HER2-позитивного молекулярно-генетического типа опухолей наблюдалась у 28,6% пациентов.
Больные раком молочной железы люминального А типа имеют благоприятный прогноз локального рецидивирования. У большинства (75,6%) больных с люминальным А типом рака молочной железы локальный рецидив возникает в сроки более 30 месяцев, у 24,4% – в период до 30 месяцев (p<0,05). Для люминального В типа, как с гиперэкспрессией онкогена HER2/neu, так и без нее, наиболее характерны средние сроки (от 30 до 60 месяцев) возникновения рецидива – 60% больных. Трижды-негативный и HER2-позитивный тип первичной опухоли сопряжен с неблагоприятным прогнозом локального рецидивирования. Трижды-негативный тип рака молочной железы статистически достоверно (p<0,05) локально рецидивирует в ранние сроки (до 30 месяцев) – 61,5% больных. У пациентов HER2-позитивного типа первичной опухоли локальный рецидив диагностируют у 83,3% больных в сроки до 60 месяцев.
Опираясь на общие принципы лечения рака молочной железы, но с учетом изменения иммуногистохимических свойств раковой опухоли, нами разработан алгоритм комплексной терапии локальных рецидивов рака молочной железы.
Выводы. К лечению локальных рецидивов рака молочной железы необходимо подходить комплексно. В тактике лечения должны учитываться молекулярно-биологические свойства локального рецидива. Внедрение в клиническую практику разработанного алгоритма позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
Ключевые слова: рак молочной железы, локальный рецидив, иммунофенотип рецидивной опухоли, молекулярно-генетические подтипы рака молочной железы.
Изучением проблемы локальных рецидивов рака молочной железы занимаются крупные мировые онкологические институты, проведены многочисленные исследования, наиболее значимые из них: Milan1, Milan2, NSABP, DBGC, SPORE, PP [1]. В вышеперечисленных исследованиях изучались сроки возникновения локальных рецидивов в зависимости от объема оперативного лечения, различных схем комплексного лечения, молекулярно-генетических подтипов рака молочной железы [2]. По результатам данных исследований разработаны практические рекомендации Американского Общества Онкологов (NCCN), Европейского общества онкологов (EORTC) [3]. Благодаря внедрению разработанных стандартов лечения рака молочной железы удалось снизить показатели смертности и увеличить выживаемость пациентов, страдающих данным заболеванием [4]. Но, несмотря на успехи комплексного лечения рака молочной железы, частота возникновения локальных рецидивов остается достаточно высокой [5]. По различным данным, частота локального рецидивирования рака молочной железы зависит от стадии заболевания и локорегионарного распространения и достигает от 4% до 22%. Перечисленные выше клинические исследования не учитывали изменения иммунофенотипа рака молочной железы. Однако иммуногистохимические показатели определяют во многом тактику лечения данной болезни. Известно, что раковая опухоль гетерогенна по клеточному составу, кроме того, геном злокачественной опухоли неустойчив и подвержен влиянию многочисленных мутационных процессов, приводящих к изменению ее фенотипических признаков [6].
Цель исследования: разработка тактики комплексного лечения локальных рецидивов с учетом изменения иммунофенотипов первичной опухоли и локального рецидива рака молочной железы.
Материалы и методы исследования
Нами проведен ретроспективный анализ историй болезней больных, прошедших лечение в республиканском онкологическом диспансере за период 10 лет. Отобранные 130 клинических случаев возникновения локального рецидива были проанализированы по следующим параметрам: результаты клинических, лабораторных методов диагностики, иммуногистохимического исследования гормональных рецепторов опухолевого тканевого маркера HER2/neu и индекса пролиферативной активности Ki67. Полученные результаты подлежали сравнению с соответствующими показателями первичных опухолей у данных пациентов. Данные историй болезней и амбулаторных карт были закодированы для обработки в статистической программе SPSS 12.0. Всего были проанализированы 20 признаков с их градациями – клинические данные, морфологические факторы и тактика лечения опухолей. После мастэктомии рецидивы возникли у 76 пациентов (1,4%), после органосохранной операции – у 54 пациентов (5,7%). Объем хирургического вмешательства при локальном рецидиве зависел от объема предшествующего хирургического лечения, размеров рецидивной опухоли и был представлен несколькими вариантами. Широкое иссечение рецидива в области послеоперационного рубца или на передней грудной стенке проведено 77 больным (59,3%), ампутация остатка молочной железы (простая мастэктомия) после органосохранной операции – 37 пациентам (28,3%), повторная органосохранная операция (в сочетании с пластической коррекцией и без) – 16 человек (12,4%).
Результаты исследования и их обсуждение
На основании исследования мы подтвердили, что раковая опухоль на фоне проводимого лечения часто меняет свои молекулярно-биологические свойства. По нашим наблюдениям, изменения произошли у 45,7% пациентов. Все возможные изменения иммунофенотипа рака молочной железы отражены на рисунке 1.
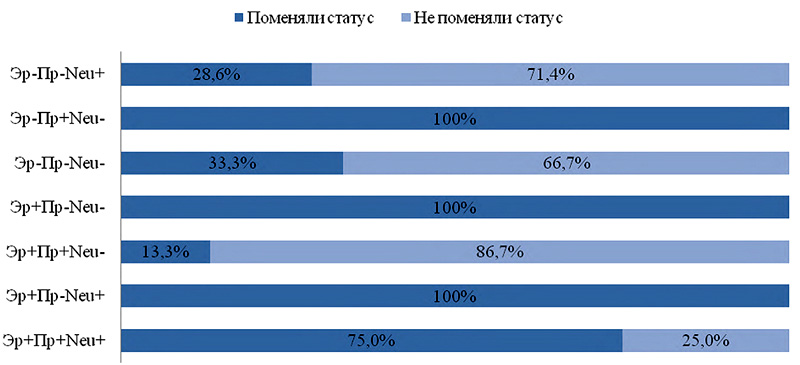
Рисунок 1. Динамика иммунофенотипа первичной опухоли РМЖ.
На рисунке представлены сочетания ИГХ-показателей рака молочной железы. В отношении каждого из них показаны изменения в процентном соотношении. Мы подтвердили большую предрасположенность к изменениям некоторых иммунофенотипов первичной опухоли по сравнению с другими. Первичные опухоли с иммунофенотипом ER+PR-Neu+, ER+PR-Neu-, ER-PR+Neu- более предрасположены к изменениям (100%, p<0,005) при возникновении локального рецидива. Опухоли с иммунофенотипом ER+PR+Neu- значительно реже меняли свой иммунофенотип (20,0%).
Для анализа клинического значения обнаруженных изменений иммуногистохимических показателей рака молочной железы полученные результаты были объединены согласно общепринятой молекулярно-генетической классификации. По нашим наблюдениям, фенотип (молекулярно-генетический подтип) рака молочной железы меняется в 31,9% случаев. Результаты распределения пациентов по иммуногистохимическим показателям первичной опухоли и локального рецидива представлены на рисунке 2.
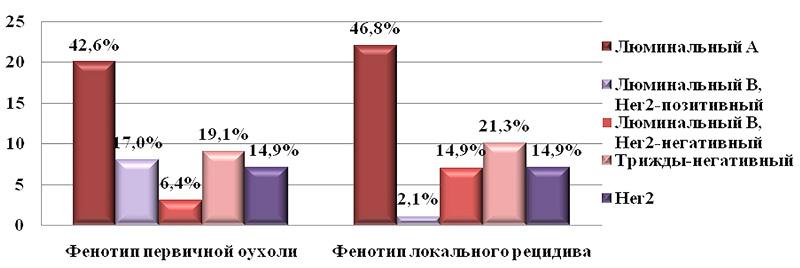
Рисунок 2. Распределение пациентов с первичной опухолью и локальными рецидивами
по молекулярно-генетическим подтипам, чел.
По нашим наблюдениям, отраженные на схеме (рис.4) изменения фенотипа рака молочной железы имеют общие принципы. По мере увеличения числа исследованных опухолей менялись только количественные (рис.3), но не качественные характеристики динамики фенотипа РМЖ. То есть можно говорить о том, что изменения иммунофенотипа рака молочной железы имеют закономерный характер.
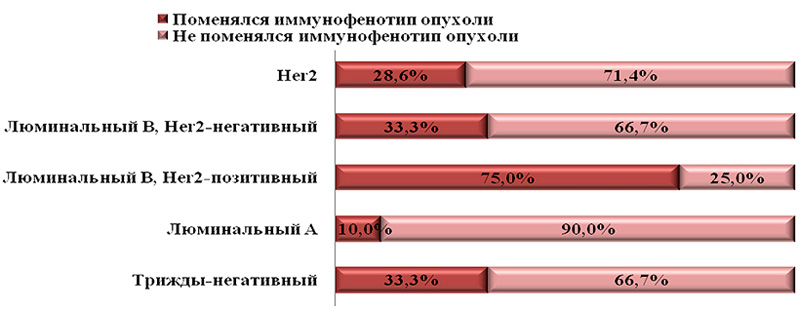
Рисунок 3. Динамика иммунофенотипа РМЖ.
Опухоли HER2-позитивного типа изменили свои молекулярно-генетические свойства в рецидивной опухоли у трети пациентов. Опухоли люминального В типа HER2-позитивного поменялись в 75% случаев. Опухоли люминального А молекулярно-генетического типа практически не менялись (10% опухолей). Опухоли трижды-негативного типа в 33,3% случаев перешли в другой подтип. Опухоли люминального B HER2-позитивного подтипа достоверно чаще других (75%, p<0,05) изменили свой иммунофенотип в рецидивной опухоли. Опухоли люминального А типа менее других молекулярно-генетических типов РМЖ склонны к динамике – 90% (p<0,05) не поменяли иммунофенотип в рецидивной опухоли. Опухоли люминального А типа, утратив экспрессию рецепторов стероидных гормонов, переходили в трижды-негативный тип. Опухоли люминального В типа, утрачивая гиперэкпрессию онкогена HER2/neu, индекса пролиферативной активности Ki67 или экспрессию рецепторов эстрогена и прогестерона либо экспрессию и тех и других, переходили в люминальный А тип, трижды-негативный или в HER2-позитивный тип. Опухоли HER2-позитивного типа начинали экспрессировать рецепторы стероидных гормонов и при этом утрачивали гиерэкспрессию онкогена HER2/neu, таким образом приобретая люминальный А фенотип в рецидивных опухолях, а утратив только экспрессию онкогена HER2/neu, становились трижды-негативными. Опухоли трижды-негативного типа, начиная экспрессировать рецепторы эстрогена и прогестерона в рецидивной опухоли, приобретали признаки люминального А фенотипа.
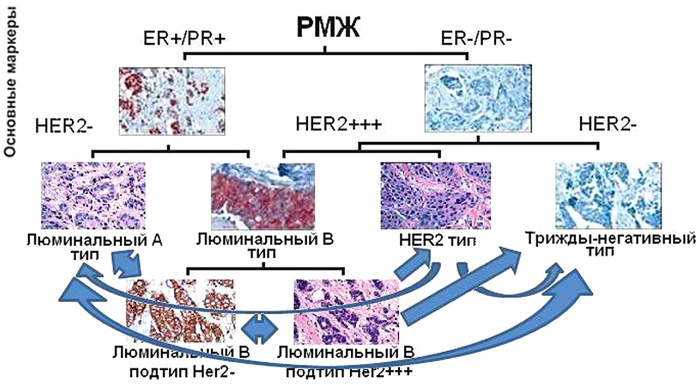
Рисунок 4. Сводная схема динамики иммунофенотипа РМЖ.
Опираясь на общие принципы лечения рака молочной железы, но с учетом изменения иммуногистохимических свойств раковой опухоли, нами разработан алгоритм комплексной терапии локальных рецидивов рака молочной железы (рис.5). Внедрение в клиническую практику разработанного алгоритма, по нашему мнению, позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
В основу алгоритма положено деление локальных рецидивов на первично-резектабельные и первично-нерезектабельные формы, ключевым является иммунодиагностика локального рецидива рака молочной железы (рис.5).
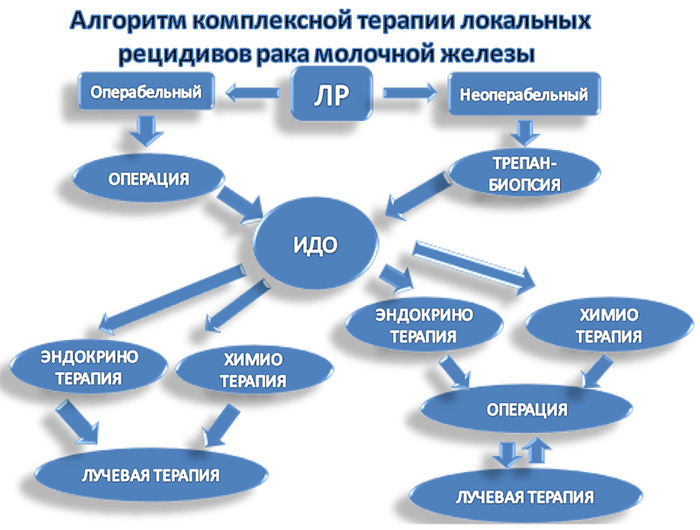
Рисунок 5. Алгоритм комплексной терапии локальных рецидивов (ЛР) РМЖ
(ИДО – иммунодиагностика опухоли).
Комплексное лечение пациентов с операбельной формой локального рецидива начинаем с хирургического удаления рецидивной опухоли. Объем хирургического вмешательства зависит от размеров рецидивной опухоли, предшествующей операции и представлен несколькими вариантами. После радикальных мастэктомий проводится иссечение рецидива в области послеоперационного рубца или на передней грудной стенке. После предшествующей органосохранной операции проводится ампутация остатка молочной железы (простая мастэктомия), если размер рецидивной опухоли превышает 2 см в наибольшем измерении. В случае, когда размер рецидивной опухоли не превышает 2 см, проводится повторная органосохранная операция (в сочетании с пластической коррекцией и без), отступая от краев опухоли не менее 2 см, и гистологическое исследование резекционных линий на степень их «чистоты». Все удаленные опухоли подвергаются гистологическому и иммуногистохимическому исследованию. В зависимости от результатов назначается лекарственная терапия. Если опухоль оказывается гормонозависимой с высокой экспрессией рецепторов стероидных гормонов (7-8 баллов), то целесообразнее всего проведение гормонотерапии II-III линии. В случае низкой экспрессии рецепторов стероидных гормонов в рецидивной опухоли или ее отсутствия проводится полихимиотерапия с последующей эндокринотерапией.
Хирургическое лечение локальных рецидивов осложненной формы в большинстве случаев затруднительно ввиду врастания в переднюю грудную стенку или близлежащие крупные сосудисто-нервные пучки, либо ввиду больших размеров рецидивной опухоли, отсутствия ее четких границ и отсутствия возможности закрытия кожного дефекта операционной раны. Поэтому комплексное лечение неоперабельных локальных рецидивов целесообразно начинать с системного лечения, основной целью которого является уменьшение размеров рецидивной опухоли для возможности дальнейшего ее удаления. В первую очередь должна проводиться системная терапия осложненной (неоперабельной) формы локальных рецидивов рака молочной железы, которая включает в себя химиотерапию и эндокринотерапию. Пациентам, ранее получавшим ПХТ I линии с антрациклин-содержащими схемами (FAC, CAF, AC), целесообразнее проводить более «агрессивные» таксан- и платино-содержащие схемы химиотерапии.
В случае, если неоперабельная форма локального рецидива сопровождается отдаленным метастазированием, рецидивная опухоль на фоне системного лечения будет являться своеобразным маркером прогрессирования заболевания и показателем ее эффективности. Данным пациентам дальнейшее оперативное лечение целесообразнее всего проводить только в случае стабилизации заболевания и его длительной ремиссии. Местное воздействие является следующим этапом комплексной терапии осложненных (неоперабельных) форм ЛР. К оперативному лечению рецидивной опухоли следует приступать только в случае регресса опухоли под воздействием системной терапии. В том случае, если достигнуть положительного эффекта от лекарственного лечения не удалось и опухоль по-прежнему хирургически нерезектабельна, целесообразно проведение лучевой терапии.
Выводы
К лечению локальных рецидивов рака молочной железы необходимо подходить комплексно. В тактике лечения должны учитываться молекулярно-биологические свойства локального рецидива. Внедрение в клиническую практику разработанного алгоритма позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
Литература
- Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomized trials. Lancet 2005; 366(9503): 2087-106.
- Smid M, Wang Y, Zhang Y, et al. Subtypes of breast cancer show preferential site of relapse. Cancer Res. 2008; 68: 3108-3114.
- Elkhuizen PHM, van Slooten H, Clahsen PC, et.al. High Local Recurrence Risk Breast-Conserving Therapy in Node-Negative Premenopausal Breast Cancer Patients Is Greatly Reduced by One Course of Perioperative Chemotherapy: A European Organization for Research and Treatment of Cancer Breast Cancer Cooperative Group Study. J.Clin.Oncol. 2000; 18: 1075-1083.
- Paridaens R, Piccart M. First line hormonal treatment for metastatic breast cancer with exemestane or tamoxifen in postmenopausal patients – A randomized phase III trial of the EORTC Breast Group. Proceeding of ASCO 40 Annual Meeting. New Orleans, 2004; 23: 6.abs.515.
- Колядина И.В., Поддубная И.В., Комов Д.В. и соавт. Срок наступления локальных рецидивов у больных первично-операбельным раком молочной железы при различной лечебной тактике. Сибирский онкологический журнал 2008; 6(30): 17-20.
- Iorio MV, Croce CM. MicroRNAs in cancer: small molecules with a huge impact. J. Clin. Oncol 2009; 27: 5848-5856.

