Лечение I и II стадий немелкоклеточного рака легкого
Для I и II стадий немелкоклеточного рака легкого (НМРЛ) характерно вовлечение в патологический процесс только одного легкого и отсутствие поражения средостения или каких-либо других структур. На раннем этапе выявляется не более 30% всех случаев НМРЛ [1].
Общие принципы терапии
Стадирование рака легкого осуществляется в соответствии с системой TNM. В настоящее время стадию НМРЛ определяют, основываясь на последней, 8-й редакции системы, принятой в 2016 году [1].
Таблица 1. Стадирование рака легкого по системе TNM 8 пересмотра [2].
| Стадия заболевания | ТХ | N0 | М0 |
|---|---|---|---|
| Стадия IA1 | T1a(mi) | N0 | M0 |
| T1a | N0 | M0 | |
| Стадия IA2 | T1b | N0 | M0 |
| Стадия IA3 | T1c | N0 | M0 |
| Стадия IB | T2a | N0 | M0 |
| Стадия IIA | T2b | N0 | M0 |
| Стадия IIB | T1a-c | N1 | M0 |
| T2a | N1 | M0 | |
| T2b | N1 | M0 | |
| T3 | N0 | M0 |
* T1a(mi) – минимально инвазивная карцинома.
Основным методом лечения I и II стадий НМРЛ является полная хирургическая резекция опухоли при отсутствии противопоказаний к операции. Для пациентов со II стадией НМРЛ показана адъювантная химиотерапия. Ее также может быть целесообразно назначать при стадии IB, особенно с признаками высокого риска. Пациентам с опухолями стадии IA после резекции адъювантная химиотерапия не показана [3].
Послеоперационная лучевая терапия показана только пациентам I и II стадии, у которых обнаружено опухолевое поражение в области резекции [4].
Лучевая терапия – альтернатива для пациентов, не являющихся кандидатами на хирургическое лечение вследствие сопутствующих заболеваний или отказа от операции [5]. Стереотаксической радиотерапии отдается предпочтение при опухолях с размерами менее 5 см. Обычное фракционирование показано пациентам с более массивными поражениями или при недоступности стереотаксической радиотерапии.
Алгоритм лечения потенциально резектабельного НМРЛ
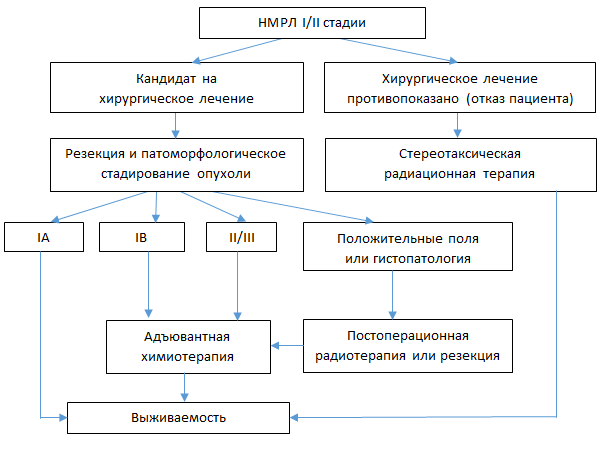
Хирургическое лечение НМРЛ
Хирургическая лечение – стандартный подход при НМРЛ I и II стадии, а также в случае отсутствия доказательств вовлечения средостения до хирургической резекции.
Анатомическая резекция – лобэктомия
Процедурой выбора считается хирургическая резекция одной доли легкого, лобэктомия, имеющая важное преимущество по сравнению с пневмонэктомией в случаях, когда поражение может быть резецировано полностью, – способность сохранять легочную функцию [6]. При этом альтернативой открытой торакотомии считается видеоторакоскопия [7], обеспечивающая снижение инвазивности лечения ранней стадии НМРЛ.
Применение видеоторакоскопии позволяет снизить последствия хирургического вмешательства, в том числе уменьшить выраженность послеоперационного болевого синдрома, что особенно важно для пациентов с тяжелой сопутствующей патологией [8]. Кроме того, благоприятная переносимость видеоторакоскопии может увеличить комплайенс постоперационной адъювантной химиотерапии. Так, анализ данных 100 пациентов с НМРЛ после лобэктомии и последующей адъювантной химиотерапии показал, что при проведении вмешательства с помощью видеоторакоскопии гораздо реже приходилось откладывать назначение химиотерапии (18% против 58%) и снижать ее дозу (26% против 49%) по сравнению с открытой торакотомией [9].
Несмотря на то, что эффективность видеоторакоскопии по сравнению с обычными хирургическими методами не была подтверждена в рандомизированных исследованиях, ретроспективные данные позволяют сделать вывод о безопасности и эффективности лобэктомии с помощью видеоторакоскопии для пациентов с I стадией НМРЛ без ущерба для выживаемости [10-13].
Сублобарная резекция
Ограниченная (сублобарная) резекция может подразумевать анатомическую или неанатомическую сегментэктомию с удалением первичной опухоли, внутрилегочных, прикорневых и медиастинальных лимфатических узлов. Сублобарная резекция может быть терапией выбора для пациентов, которые не в состоянии перенести удаление всей доли легкого вследствие снижения функции легких, преклонного возраста или тяжелой сопутствующей патологии.
Результаты ряда исследований свидетельствуют, что сублобарная резекция связана с худшими показателями выживаемости по сравнению с лобэктомией [6,14]. По различным данным, при неанатомической резекции увеличивается частота местного рецидива на 5-10% [15]. Предложенная в качестве способа уменьшения частоты локального рецидива при сублобарной резекции интраоперационная брахитерапия, к сожалению, оказалась неэффективной, что подтверждено данными клинического исследования III фазы ALLIANCE [16], свидетельствующими об отсутствии существенной разницы между сублобарной резекцией с и без сочетания с интраоперационной брахитерапией.
Однако существует и противоположная точка зрения, утверждающая, что эффективность сублобарной резекции на ранних стадиях НМРЛ, особенно при размере поражения не более 2 см, может быть сравнима с результатом, полученным после лобэктомии [17].
Медиастенальная лимфаденэктомия
Согласно рекомендациям Европейского общества торакальных хирургов 2006 года, целесообразно проводить систематическое удаление лимфоузлов во всех случаях с целью обеспечения полноты резекции [18]. Такая же тактика декларируется и в рекомендациях Британского торакального общества 2010 года [19].
Согласно федеральным российским рекомендациям, стандартным объемом медиастинальной лимфаденэктомии при операциях на правом легком считается удаление правых нижних паратрахеальных (трахеобронхиальных, паратрахеальных, претрахеальных) узлов, на левом легком – парааортальных, субаортальных, левых нижних паратрахеальных узлов, а также независимо от стороны операции – бифуркационных, параэзофагеальных и узлов легочной связки соответствующих сторон [15].
Согласно рекомендациям Европейского общества торакальных хирургов ESTS [20], у пациентов с минимальным получением образцов тканей лимфоузлов, независимо от местоположения первичной опухоли, необходимо исследовать следующие уровни лимфоузлов и удаленные узлы, при наличии таковых:
- Правосторонние опухоли: уровни лимфоузлов 4R, 7, 8, 9, 10R
- Левосторонние опухоли: уровни лимфоузлов 5, 6, 7, 8, 9, 10L
У пациентов с систематической радикальной средостеночной лимфаденэктомией вся доступная средостеночная жировая ткань, относящаяся к одной стороне тела, подлежит удалению, включая следующие уровни:
- Правосторонние опухоли: уровни лимфоузлов 2R, 4R, 7, 8, 9, 10R
- Левосторонние опухоли: уровни лимфоузлов 5, 6, 7, 8, 9, 10L, и 4L, если доступно
Пациенты, у которых не все упомянутые уровни лимфоузлов были удалены, автоматически классифицируются как имеющие «минимальное получение образцов ткани лимфоузлов».
При метастатическом поражении лимфоузлов средостения показана расширенная медиастинальная лимфаденэктомия, подразумевающая удаление превенозных, ретротрахеальных и верхних паратрахеальных узлов с окружающей клетчаткой соответствующей стороны [15].
При микроскопическом вовлечении опухолевых клеток по линии резекции (R1) прогноз заболевания значительно менее благоприятный по сравнению с резекцией с отрицательными микроскопическими полями (R0) [21,22].
Для пациентов со стадией IIB вследствие вовлечения в опухолевый процесс грудной стенки может быть показана резекция грудной стенки в едином блоке с опухолью и тканью легкого («en-bloc»). По данным ретроспективного исследования с участием 212 пациентов, это позволило достичь высоких показателей выживаемости в течение пяти лет [23].
Частота локального рецидива после хирургического вмешательства у пациентов с НМРЛ I и II стадии составляет, по разным данным, от 6% до 55% [24,25].
Адъювантная терапия
После потенциально радикальной резекции опухоли при НМРЛ существует вероятность прогрессирования заболевания вследствие отдаленного метастазирования или местного рецидива. Адъювантная химиотерапия после радикальных операций у некоторых больных на ранних стадиях заболевания (IB и II) позволяет улучшить безрецидивную и общую 5-летнюю выживаемость.
Химиотерапия
Клинические исследования, в которых в качестве адъювантной химиотерапии применялись современные схемы на основе цисплатина, продемонстрировали преимущество в выживаемости для пациентов с НМРЛ II стадии и, возможно, со стадией IB [26], но не подтвердили эффективность у пациентов со стадией IA [27].
Адъювантную терапию назначают после восстановления пациента от хирургического лечения (но не позже 8 недель), ее длительность в среднем составляет 3-4 цикла. Для химиотерапии можно использовать любые платиносодержащие комбинации с включением препаратов 3 поколения или этопозида. Наиболее изученными считаются комбинации винорельбина и цисплатина, гемцитабина и цисплатина, паклитаксела и карбоплатина [15].
Таргетная терапия
Определенных рекомендаций по назначению таргетных препаратов в качестве адъювантной терапии на сегодня не существует. Данные ряда исследований свидетельствуют, что у пациентов с мутацией EGFR на ранней стадии заболевания (особенно на стадии IIIA после резекции опухоли) назначение в качестве адъювантного лечения эрлотиниба сопряжено с увеличением выживаемости без рецидива [26, 28]. Однако неизвестно, свидетельствуют ли эти результаты об улучшении общей выживаемости или о пролонгировании времени до рецидива.
В то же время в работе Kelly K с соавт. с участием 973 пациентов с НМРЛ и мутацией в гене EGFR [29] было показано, что адъювантная химиотерапия эрлотинибом не пролонгирует выживаемость без рецидива. Столь противоречивые данные свидетельствуют о необходимости дальнейших исследований эффективности ингибиторов тирозинкиназы в качестве адъювантной химиотерапии у EGFR-позитивных пациентов с НМРЛ.
Прогноз НМРЛ I и II стадии
Общая пятилетняя выживаемость при НМРЛ составляет от 10% до 15%, что прежде всего обусловлено высокой долей пациентов с заболеванием III и IV стадии [36]. Анализ более чем 31 000 случаев рака легкого показал, что с увеличением клинической стадии заболевания с IA, IB, IIA, IIB пятилетняя выживаемость составляла 50%, 43% ,36% и 25% соответственно [36].
У пациентов со стадией I и II НМРЛ на прогноз заболевания влияет ряд факторов, среди которых:
- Наличие изолированных опухолевых клеток в региональных лимфатических узлах. Так, при выявлении опухолевых клеток в лимфатических узлах прогноз НМРЛ гораздо менее благоприятный, чем при отсутствии таковых [37]
- Гистологический тип опухоли. Ретроспективное изучение данных 5018 пациентов Mayo Clinic показало, что класс опухоли является третьим по счету предиктивным фактором после стадии и объема полученной терапии, влияющим на прогноз заболевания [38]
- Наличие молекулярных маркеров. Например, наличие мутации в гене EGFR сопряжено с лучшим прогнозом вследствие положительного ответа на ингибиторы тирозинкиназы EGFR.
- Наличие сопутствующей патологии. В исследовании с участием 451 пациента [39] было показано, что трехлетняя выживаемости пациентов с НМРЛ I стадии были значительно ниже при наличии коморбидной патологии (86%, 75%, 69% и 70% при отсутствии, незначительной, умеренной и тяжелой степени соответственно)
- Качество оказания медицинской помощи. Исследования свидетельствуют, что пациенты, получающие хирургическую помощь в учреждениях с большим опытом соответствующих вмешательств, имеют лучший прогноз по сравнению с пациентами, прооперированными в клиниках с низким числом подобных процедур [40]
Постоперационное наблюдение
Целью постоперационного наблюдения после первичного лечения НМРЛ является раннее обнаружение рецидива или второго первичного рака легкого.
Физический осмотр, КТ грудной клетки рекомендовано проводить каждые 6 месяцев на протяжении первых двух лет после лечения, а затем – ежегодно [41]. Однако на конгрессе Европейского общества медицинской онкологии ESMO 2017 года в Мадриде были представлены результаты исследования с участием 1775 пациентов с полностью резецированным НМРЛ I-II-IIIA стадии, продемонстрировавшие отсутствие разницы в общей выживаемости между пациентами, проходящими КТ-сканирование каждые 6 месяцев в первые два года после операции, и пациентами, не делающими этого исследования.
Тем не менее, наблюдение на основе КТ по-прежнему остается оптимальным способом контроля из-за возможного развития повторного случая первичного рака у пациентов после полной резекции НМРЛ.
Список литературы
- Groome P.A., et al. The IASLC Lung Cancer Staging Project: Validation of the Proposals for Revision of the T, N, and M Descriptors and Consequent Stage Groupings in the Forthcoming (Seventh) Edition of the TNM Classification of Malignant Tumours. J. Thorac. Oncol. 2007. Vol.2, №8, P. 694-705.
- Goldstraw P., et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J. Thorac. Oncol. 2016. Vol.11, №1, P. 39-51.
- Arriagada R., et al. Cisplatin-Based Adjuvant Chemotherapy in Patients with Completely Resected Non-Small-Cell Lung Cancer. N. Engl. J. Med. 2004. Vol.350, №4, P. 351-360.
- PORT Meta-analysis Trialists Group. Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database of Systematic Reviews. ed. Rydzewska L. Chichester, UK: John Wiley & Sons, Ltd, 2005. №2, P. CD002142.
- Wang E.H., et al. Postoperative Radiation Therapy Is Associated With Improved Overall Survival in Incompletely Resected Stage II and III Non-Small-Cell Lung Cancer. J. Clin. Oncol. 2015. Vol.33, №25, P. 2727-2734.
- Ginsberg R.J., Rubinstein L.V. Randomized trial of lobectomy versus limited resection for T1 N0 non-small cell lung cancer. Ann. Thorac. Surg. 1995. Vol.60, №3, P. 615-623.
- Yan T.D., et al. Systematic review and meta-analysis of randomized and nonrandomized trials on safety and efficacy of video-assisted thoracic surgery lobectomy for early-stage non-small-cell lung cancer. J. Clin. Oncol. American Society of Clinical Oncology, 2009. Vol.27, №15, P. 2553-2562.
- Mentzer S.J., et al. Thoracoscopy and Video-Assisted Thoracic Surgery in the Treatment of Lung Cancer. Chest. 1995. Vol.107, №6, P. 298S-301S.
- Petersen R.P., et al. Thoracoscopic Lobectomy Facilitates the Delivery of Chemotherapy after Resection for Lung Cancer. Ann. Thorac. Surg. 2007. Vol.83, №4, P. 1245-1250.
- Yang C.-F.J., et al. Use and Outcomes of Minimally Invasive Lobectomy for Stage I Non-Small Cell Lung Cancer in the National Cancer Data Base. Ann. Thorac. Surg. 2016. Vol.101, №3, P. 1037-1042.
- Swanson S.J., et al. Video-assisted thoracic surgery lobectomy: report of CALGB 39802 – a prospective, multi-institution feasibility study. J. Clin. Oncol. American Society of Clinical Oncology, 2007. Vol.25, №31, P. 4993-4997.
- Flores R.M., et al. Lobectomy by video-assisted thoracic surgery (VATS) versus thoracotomy for lung cancer. J. Thorac. Cardiovasc. Surg. 2009. Vol.138, №1, P. 11-18.
- Paul S., et al. Long term survival with thoracoscopic versus open lobectomy: propensity matched comparative analysis using SEER-Medicare database. BMJ. 2014. Vol.349.
- Dai C., et al. Choice of Surgical Procedure for Patients With Non-Small-Cell Lung Cancer ≤1 cm or >1 to 2 cm Among Lobectomy, Segmentectomy, and Wedge Resection: A Population-Based Study. J. Clin. Oncol. American Society of Clinical Oncology, 2016. Vol.34, №26, P. 3175-3182.
- Амиралиев А.М. с соавт. Федеральные клинические рекомендации по диагностике и лечению больных раком легкого. Москва, 2014.
- Fernando H.C., et al. Impact of brachytherapy on local recurrence rates after sublobar resection: results from ACOSOG Z4032 (Alliance), a phase III randomized trial for high-risk operable non-small-cell lung cancer. J. Clin. Oncol. American Society of Clinical Oncology, 2014. Vol.32, №23, P. 2456-2462.
- Sakurai H., Asamura H. Sublobar resection for early-stage lung cancer. Transl. lung cancer Res. AME Publications, 2014. Vol.3, №3, P. 164-172.
- Lardinois D., et al. ESTS guidelines for intraoperative lymph node staging in non-small cell lung cancer. Eur. J. Cardio-Thoracic Surg. Wiley-Liss, New York, 2006. Vol.30, №5, P. 787-792.
- Lim E., et al. Guidelines on the radical management of patients with lung cancer. Thorax. 2010. Vol.65, Suppl 3, P. iii1-iii27.
- Lardinois D., et al. ESTS guidelines for intraoperative lymph node staging in non-small cell lung cancer. Eur. J. Cardio-Thoracic Surg. Oxford University Press, 2006. Vol.30, №5, P. 787-792.
- Robinson B.M., et al. Node-Negative Non-small Cell Lung Cancer: Pathological Staging and Survival in 1765 Consecutive Cases. J. Thorac. Oncol. 2011. Vol.6, №10, P. 1691-1696.
- Vallières E., et al. Carcinoma In Situ at the Bronchial Resection Margin: A Review. J. Thorac. Oncol. 2011. Vol.6, №10, P. 1617-1623.
- Doddoli C., et al. Lung Cancer Invading the Chest Wall: A Plea for En-Bloc Resection but the Need for New Treatment Strategies. Ann. Thorac. Surg. 2005. Vol.80, №6, P. 2032-2040.
- Kelsey C.R., et al. Local recurrence after surgery for early stage lung cancer. Cancer. Wiley Subscription Services, Inc., A Wiley Company, 2009. Vol.115, №22, P. 5218-5227.
- Cai X.-W., et al. Comparative Survival in Patients With Postresection Recurrent Versus Newly Diagnosed Non-Small-Cell Lung Cancer Treated With Radiotherapy. Int. J. Radiat. Oncol. 2010. Vol.76, №4, P. 1100-1105.
- Strauss G.M., et al. Adjuvant paclitaxel plus carboplatin compared with observation in stage IB non-small-cell lung cancer: CALGB 9633 with the Cancer and Leukemia Group B, Radiation Therapy Oncology Group, and North Central Cancer Treatment Group Study Groups. J. Clin. Oncol. American Society of Clinical Oncology, 2008. Vol.26, №31, P. 5043-5051.
- Pisters K.M.W., et al. Cancer Care Ontario and American Society of Clinical Oncology adjuvant chemotherapy and adjuvant radiation therapy for stages I-IIIA resectable non small-cell lung cancer guideline. J. Clin. Oncol. American Society of Clinical Oncology, 2007. Vol.25, №34, P. 5506-5518.
- Pennell N.A., et al. SELECT: A multicenter phase II trial of adjuvant erlotinib in resected early-stage EGFR mutation-positive NSCLC. J. Clin. Oncol. 2014.
- Kelly K., et al. Adjuvant Erlotinib Versus Placebo in Patients With Stage IB-IIIA Non-Small-Cell Lung Cancer (RADIANT): A Randomized, Double-Blind, Phase III Trial. J. Clin. Oncol. 2015. Vol.33, №34, P. 4007-4014.
- Bezjak A., et al. Definitive and Adjuvant Radiotherapy in Locally Advanced Non-Small-Cell Lung Cancer: American Society of Clinical Oncology Clinical Practice Guideline Endorsement of the American Society for Radiation Oncology Evidence-Based Clinical Practice Guideline. J. Clin. Oncol. American Society of Clinical Oncology, 2015. Vol.33, №18, P. 2100-2105.
- Group T.L.C.S. Effects of Postoperative Mediastinal Radiation on Completely Resected Stage II and Stage III Epidermoid Cancer of the Lung. N. Engl. J. Med. Massachusetts Medical Society , 1986. Vol.315, №22, P. 1377-1381.
- Stephens R.J., et al. The role of post-operative radiotherapy in non-small-cell lung cancer: a multicentre randomised trial in patients with pathologically staged T1-2, N1-2, M0 disease. Medical Research Council Lung Cancer Working Party. Br. J. Cancer. Nature Publishing Group, 1996. Vol.74, №4, P. 632-639.
- Lally B.E., et al. Postoperative radiotherapy for stage II or III non-small-cell lung cancer using the surveillance, epidemiology, and end results database. J. Clin. Oncol. American Society of Clinical Oncology, 2006. Vol.24, №19, P. 2998-3006.
- Burdett S., et al. Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database of Systematic Reviews. ed. Burdett S. Chichester, UK: John Wiley & Sons, Ltd, 2016. Vol.10, P. CD002142.
- Postoperative radiotherapy in non-small-cell lung cancer: systematic review and meta-analysis of individual patient data from nine randomised controlled trials. PORT Meta-analysis Trialists Group. Lancet (London, England). 1998. Vol.352, №9124, P. 257-263.
- Goldstraw P., et al. The IASLC Lung Cancer Staging Project: Proposals for the Revision of the TNM Stage Groupings in the Forthcoming (Seventh) Edition of the TNM Classification of Malignant Tumours. J. Thorac. Oncol. 2007. Vol.2, №8, P. 706-714.
- Rusch V.W., et al. Occult Metastases in Lymph Nodes Predict Survival in Resectable Non-Small-Cell Lung Cancer: Report of the ACOSOG Z0040 Trial. J. Clin. Oncol. American Society of Clinical Oncology, 2011. Vol.29, №32, P. 4313-4319.
- Sun Z., et al. Histologic grade is an independent prognostic factor for survival in non-small cell lung cancer: An analysis of 5018 hospital- and 712 population-based cases. J. Thorac. Cardiovasc. Surg. 2006. Vol.131, №5, P. 1014-1020.
- Battafarano R.J., et al. Impact of comorbidity on survival after surgical resection in patients with stage I non-small cell lung cancer. J. Thorac. Cardiovasc. Surg. 2002. Vol.123, №2, P. 280-287.
- Lüchtenborg M., et al. High procedure volume is strongly associated with improved survival after lung cancer surgery. J. Clin. Oncol. American Society of Clinical Oncology, 2013. Vol.31, №25, P. 3141-3146.
- Ettinger D.S., et al. Non-Small Cell Lung Cancer, Version 5.2017, NCCN Clinical Practice Guidelines in Oncology. J. Natl. Compr. Canc. Netw. Harborside Press, LLC, 2017. Vol.15, №4, P. 504-535.




