Чувствительность перевиваемых опухолей животных
к противоопухолевому препарату ритуксимаб
Л.А. Островская, Д.Б. Корман, М.М. Фомина, Н.В. Блюхтерова, В.А. Рыкова
Институт биохимической физики имени Н.М. Эмануэля РАН, Москва*
Резюме
Исследована чувствительность к ритуксимабу ряда экспериментальных опухолей животных – лимфолейкозы L-1210 и Р-388, эпидермоидная карцинома легкого Lewis, аденокарцинома толстой кишки АКАТОЛ, аденокарцинома молочной железы Ca-755, меланома В-16. Установлено, что ростингибирующий эффект препарата колеблется в пределах от 30 до 70% торможения роста опухоли, изменяясь в зависимости от штамма опухоли и схемы применения препарата. Наибольшую чувствительность к ритуксимабу проявили солидные опухоли карцинома Са-755 и меланома В-16.
Ключевые слова: ритуксимаб (мабтера), перевиваемые опухоли животных.
The sensitivity of transplanted animal tumors to rituximab
L.A. Ostrovskaya, D.B. Korman, M.M. Fomina, N.V. Bluchterova, V.A. Rikova
N.M. Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, Moscow
Abstract
The sensitivity of some animal tumor systems, such as L-1210 and P-388 leukemias as well as Lewis lung carcinoma, ACATOL adenocarcinoma, Ca-755 adenocarcinoma and B-16 melanoma to rituximab was studied. The antitumor activity of the drug was in dependence from the kind of tumor strain and the schedule of the drug administration – the index of the tumor growth inhibition for this drug against mentioned above tumors varied in the interval from 30 to 70% in comparison with control. Two solid tumors, namely, Ca-755 adenocarcinoma and B-16 melanoma were the most sensitive to the drug.
Key words: rituksimab (mabtera), transplanted animal rumors.
Введение
Одним из основных направлений в создании новых эффективных противоопухолевых препаратов в последние полтора десятилетия стала разработка так называемых «таргетных» препаратов, обладающих направленным воздействием на заранее определенные молекулярные мишени, в той или иной степени связанные с опухолевым ростом [3].
Среди таргетных препаратов первым, внедренным в клиническую онкологию лекарственным средством, явился препарат ритуксимаб (мабтера), представляющий собой моноклональное антитело к трансмембранному антигену CD20, экспрессируемому на поверхности В-лимфоцитов [1,3,6-12].
На примере этого препарата была показана принципиальная возможность и перспективность использования моноклональных антител для эффективной противоопухолевой терапии [3,6].
Основным показанием к применению ритуксимаба является В-клеточная неходжкинская лимфома всех форм. По мере клинического изучения препарата показания к его применению расширяются за счет включения некоторых других видов опухолей [3,6,7].
В настоящее время в клинической практике используется более десятка противоопухолевых препаратов, являющихся моноклональными антителами различного механизма действия, большое число подобных препаратов находится на различных этапах клинических исследований [1,7].
При создании новых таргетных препаратов на этапе доклинических исследований весьма существенной задачей представляется подбор адекватных экспериментальных моделей для оценки их противоопухолевой эффективности.
Исследование таргетных препаратов обычно проводится in vitro на заведомо содержащих выбранные мишени стабильных клеточных линиях опухолей человека, либо в условиях in vivo на ксенографтах этих опухолей на мышах «nude».
Однако нельзя исключить, что механизм противоопухолевого действия таргетных препаратов не ограничивается взаимодействием с какой-либо одной определенной мишенью, а может быть существенно более сложным, что требует дополнительных исследований на других опухолевых моделях [7].
Данные о чувствительности наиболее широко применяющихся в доклинических исследованиях перевиваемых опухолей животных к таргетным препаратам, в частности к ритуксимабу, в литературе отсутствуют.
Вместе с тем изучение реакции перевиваемых опухолей животных на воздействие таргетных препаратов могло бы способствовать получению новой дополнительной информации, как о свойствах исследуемых соединений, так и о биологических характеристиках тестируемых опухолевых моделей.
В связи с вышеизложенным задача данной работы состояла в оценке чувствительности стандартных перевиваемых опухолей животных, широко используемых в доклинических исследованиях, к препарату ритуксимаб.
Исследована эффективность препарата при различных схемах применения в отношении шести моделей перевиваемых опухолей: лимфолейкоз L-1210, лимфолейкоз Р-388 в асцитной и солидной формах, эпидермоидная карцинома легкого Lewis, аденокарцинома толстой кишки АКАТОЛ, аденокарцинома молочной железы Са-755, меланома В-16.
Материалы и методы
Препарат. В исследовании использован коммерческий препарат «Мабтера» (Ритуксимаб) производства фирмы Roche, Франция, предоставленный Центром инженерной иммунологии биотехнологической компании «Биокад». Препарат применялся внутрибрюшинно (в/б) в 0,9% NaCl по 0,2 мл, в разовых дозах 5 и 10 мг/кг, при различных схемах введения – ежедневно в течение пяти дней, либо двух- или трёхкратно с интервалами 3 или 7 суток между инъекциями. Применение препарата начиналось на 1-е сутки после перевивки лейкозов и на 1-3 сутки после перевивки солидных опухолей.
Лабораторные животные. Исследование проведено на мышах BDF1 – f1(DBA2 x C57Bl/6) и мышах линии BALВ/c, самцах с массой тела 18-20 г разведения питомника РАМН «Столбовая». Группы подопытных животных состояли из 6-8 мышей, эксперименты воспроизведены 2-3 раза.
Экспериментальные модели. Экспериментальными моделями служили лимфолейкозы L-1210 и Р-388 (трансплантация в/б и подкожно), а также солидные опухоли – эпидермоидная карцинома легкого Lewis (LLC), аденокарцинома толстой кишки АКАТОЛ, аденокарцинома молочной железы Ca-755, меланома В-16, полученные исходно из Банка опухолевых штаммов РОНЦ РАМН. Перевивка опухолей осуществлялась в соответствии со стандартными методиками [5].
Оценка противоопухолевого эффекта. Противоопухолевая активность препарата на моделях экспериментальных лейкозов оценивалась на основании сопоставления средней продолжительности жизни в группах леченных и контрольных животных. Полученные данные представлены в таблице в виде усреднённых для 12-16 животных значений.
Оценка эффекта мабтеры на моделях солидных опухолей проведена на основе изучения кинетики роста опухолей в группах леченных и контрольных животных.
Для изучения кинетики роста опухолей проводилось измерение двух взаимно-перпендикулярных размеров опухолевого узла на протяжении всего периода развития опухолей. Объем опухоли вычислялся в соответствии с формулой для эллипсоида V = ab2/2, где а – длина, b – ширина и высота опухолевого узла. Масса опухоли соответствует ее объему, поскольку плотность опухолевой ткани принято считать равной 1 г/см3 [5].
Для оценки противоопухолевого эффекта препарата использованы стандартные показатели – коэффициенты изменения средней продолжительности жизни (Δτ,%) и торможения роста опухоли (ТРО%), характеризующие изменение соответствующего показателя – средней продолжительности жизни τ или средней массы опухоли Р под влиянием испытуемого препарата у леченных животных (Т) по сравнению с контролем (С) и определяемые как Δτ=(τС – τТ)/τС,% и ТРО=(РС-РТ)/РС,%, соответственно.
Минимально значимым принято считать ТРО>50% [4,5].
Результаты экспериментов представлены в виде кинетических кривых, каждая точка которых соответствует данным, полученным от 6-18 животных.
Статистическая обработка данных проведена с использованием пакета компьютерных программ «Statistica 6.0». Оценка достоверности различий между средними значениями, характеризующими массу опухоли в группах контрольных и леченных животных, проведена с помощью t-критерия Стьюдента. Различия между леченными и контрольными группами животных признаются достоверными при условии, что вычисленные значения t превышают значения критерия Стьюдента для определённых уровней значимости при заданном числе степеней свободы f [2].
Наблюдение за животными продолжалось в течение всего периода развития опухоли вплоть до гибели животных.
Результаты исследования
Исследование противоопухолевой эффективности препарата ритуксимаб на шести моделях перевиваемых опухолей позволило выявить различия в их чувствительности к препарату.
Влияние препарата ритуксимаб на развитие в/б трансплантированных лимфолейкозов L-1210 и Р-388 характеризуют данные, представленные в таблице 1. Как видно, сроки жизни животных, получавших мабтеру в суточной дозе 10 мг/кг двукратно, не отличаются от продолжительности жизни контрольных мышей. Иными словами, ритуксимаб не обладает способностью ингибировать развитие лейкозов L-1210 и Р-388, перевитых в/б.
Таблица 1. Влияние препарата ритуксимаб на продолжительность жизни животных с перевиваемыми лейкозами.
| Штамм | Разовая доза и схема введения препарата |
Средняя продолжительность жизни животных (сутки) |
|
|---|---|---|---|
| Ритуксимаб | Контроль | ||
| Лейкоз L-1210 | 10 мг/кг 1 и 4 сутки |
6,6±0,9 | 7,0±0,0 |
| Лейкоз Р-388 | 10 мг/кг 1 и 4 сутки |
10,7±2,2 | 10,3±1,2 |
Лейкоз Р-388, перевитый подкожно, проявляет определённую чувствительность к препарату – торможение роста опухоли составило 50% по сравнению с контролем при введении ритуксимаба трехкратно с интервалом в семь суток между инъекциями (рис.1, табл.2,3).
Рассматривая эффективность ритуксимаба в отношении других солидных опухолей, таких как карцинома Lewis (LLC) и аденокарцинома АКАТОЛ, следует отметить весьма умеренный ростингибирующий эффект препарата на этих моделях (рис.2, 3).
Чувствительность данных штаммов к препарату, вводимому пятикратно, ежедневно, соответствует 40% торможению роста опухоли, а при другом режиме – трёхкратное введение с интервалом в семь суток между инъекциями – 30% торможению роста опухоли по сравнению с контролем (табл. 2).
Таблица 2. Ростингибирующий эффект препарата ритуксимаб
в отношении ряда солидных опухолей животных.
| Разовая доза и схема введения препарата | Штамм опухоли | ||||||
|---|---|---|---|---|---|---|---|
| Меланома В-16 | Карцинома Са-755 | Карцинома LLC | Карцинома АКАТОЛ | Лейкоз Р-388 | |||
| Торможение роста опухоли, %*) | |||||||
| 10 мг/кг трехкратно 1, 7, 14 сутки |
70 (21 сутки) |
70 (21 сутки) |
30 (21 сутки) |
30 (21 сутки) |
50 (16 сутки) |
||
| 5 мг/кг пятикратно 3-7 сутки |
30 (22 сутки) |
40 (12 сутки) |
40 (16 сутки) |
40 (21 сутки) |
0 (16 сутки) |
||
*) В скобках указаны сроки определения максимального противоопухолевого эффекта (сутки после перевивки опухоли)
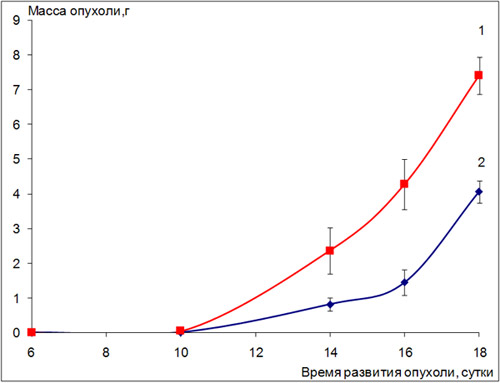
Рис. 1. Влияние препарата ритуксимаб на развитие лейкоза Р-388 в солидной форме (мыши BDF1)
1 - контроль; 2 - ритуксимаб, 10 мг/кг/сутки, в/б, трехкратно еженедельно на 1, 8 и 15 сутки после перевивки опухоли
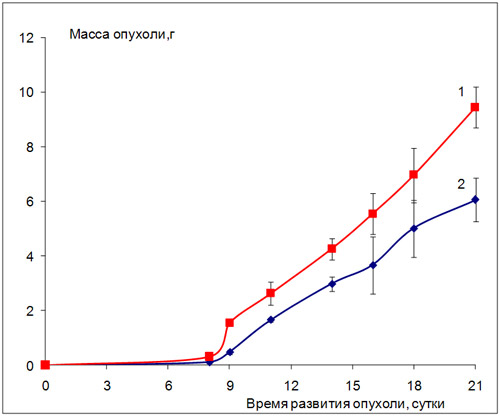
Рис. 2. Влияние препарата ритуксимаб на развитие карциномы Льюис (мыши BDF1)
1 - контроль; 2 - ритуксимаб, 5 мг/кг/сутки, в/б, пятикратно, ежедневно, начиная со следующих суток после перевивки опухоли
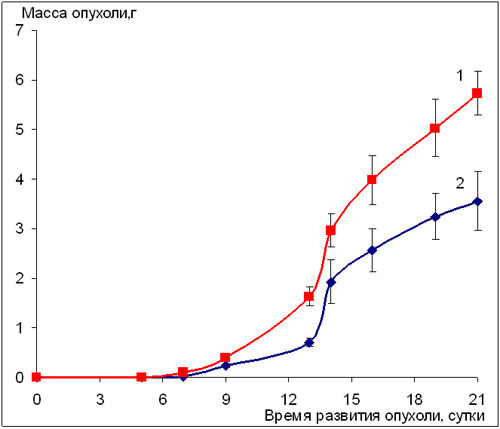
Рис. 3. Влияние препарата ритуксимаб на развитие аденокарциномы Акатол (мыши линии BALB/с)
1 - контроль; 2 - ритуксимаб, 5 мг/кг/сутки, в/б, пятикратно, ежедневно, начиная со следующих суток после перевивки опухоли.
Несколько более высокая чувствительность к действию ритуксимаб выявлена у двух других штаммов солидных опухолей – аденокарцинома Ca-755 (рис.4) и меланома В-16 (рис.5) при определённой схеме введения препарата.
Так, развитие аденокарциномы Ca-755 у животных, получавших ритуксимаб в суточной дозе 10 мг/кг трёхкратно на 1, 7 и 14 сутки после перевивки опухоли, к моменту окончания курса введений препарата ингибируется на 70% по сравнению с контролем. Этот эффект сохраняется на протяжении последующих шести суток развития опухоли (рис.4Б, табл.2,3).
Ежедневное пятикратное введение ритуксимаба, в период с 3 по 7 сутки после перевивки опухоли, в суточной дозе 5 мг/кг приводит к торможению роста опухоли на 40% по сравнению с контролем (рис.4А, табл.2).
На модели меланомы В-16 трёхкратное еженедельное введение ритуксимаба в разовой дозе 10 мг/кг в сутки также оказалось более эффективным, чем ежедневное пятикратное применение препарата в суточной дозе 5 мг/кг. Ростингибирующий эффект ритуксимаба при двух указанных схемах применения препарата соответствует 70% и 30% торможения роста опухоли по сравнению с контролем и наблюдается на 21 и 22 сутки развития опухоли, т.е. спустя 6 и 17 суток после последнего введения препарата, соответственно (рис.5, табл.2).
Сопоставление двух схем применения ритуксимаба, из которых одна – введение препарата с интервалом в 7 суток трехкратно – является стандартной для данного препарата, выявило существенное преимущество стандартного режима применения препарата в отношении моделей аденокарциномы Ca-755 и меланомы В-16 по сравнению с его ежедневным пятикратным введением. Достоверность наблюдаемого ростингибирующего эффекта ритуксимаба иллюстрируют данные, представленные в таблице 3.
Таким образом, полученные результаты свидетельствует о том, что наибольшую чувствительность к препарату ритуксимаб среди изученных опухолей проявляют меланома В-16 и аденокарцинома Са-755. При оптимальном режиме применения ритуксимаба максимальный противоопухолевый эффект препарата составляет 70% торможения роста данных опухолей.
Таблица 3. Противоопухолевая активность ритуксимаба на моделях солидных опухолей, чувствительных к препарату (Введение ритуксимаба в разовой дозе 10 мг/кг на 1, 7 и 14 сутки после перевивки опухоли).
| Штамм опухоли | Срок после перевивки (сутки) | ТРО (%) | Средняя масса опухоли (г) Ритуксимаб Контроль | Критерий Стьюдента t |
|---|---|---|---|---|
| Меланома В-16 | 21 | 70 | 7,8±1,1 19,0±1,1 | 7,22>t0,001=4,58 f=10 |
| Карцинома Са-755 | 21 | 70 | 14,4±2,3 22,6±2,1 | 2,69>t0,05=2,22 f=10 |
| Лейкоз Р-388 | 16 | 50 | 1,4±0,4 4,3±0,7 | 3,45>t0,01=3,05 f=12 |
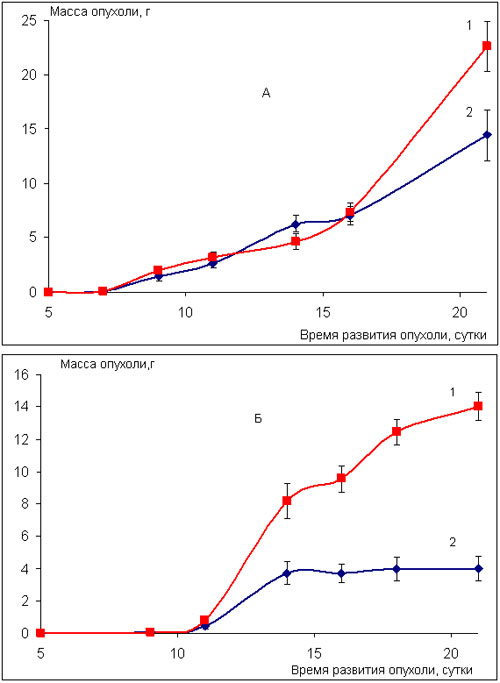
Рис. 4. Влияние препарата ритуксимаб на развитие карциномы 755 (мыши BDF1)
1 – контроль; 2 – ритуксимаб:
А – ритуксимаб, 5 мг/кг в сутки, в/б, пятикратно, ежедневно, начиная с 3-х суток после перевивки опухоли;
Б – ритуксимаб, 10 мг/кг в сутки, в/б, трехкратно, еженедельно, начиная с 1 суток после перевивки опухоли.
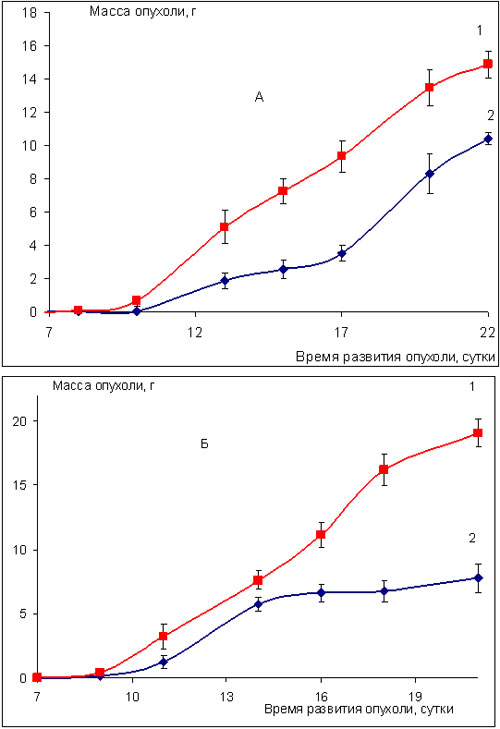
Рис. 5. Влияние препарата ритуксимаб на развитие меланомы В-16 (мыши BDF1)
1 – контроль; 2 – ритуксимаб:
А – ритуксимаб, 5 мг/кг в сутки, в/б, пятикратно, ежедневно, начиная с 3-х суток после перевивки опухоли;
Б – ритуксимаб, 10 мг/кг в сутки, в/б, трехкратно, еженедельно, начиная с 1 суток после перевивки опухоли.
Обсуждение результатов
С момента регистрации FDA в 1997 году ритуксимаба в качестве средства для терапии определенных форм В-клеточной неходжкинской лимфомы, препарат вошел в число основных лекарственных средств, применяемых при лечения больных этой опухолью, а также хроническим лимфолейкозом. Возможности использования препарата для лечения других опухолей не исследованы.
Механизм противоопухолевого действия ритуксимаба связывают с индукцией иммунологической цитотоксической реакции (антител-зависимая клеточная цитотоксичность и комплимент-зависимая цитотоксичность), приводящей впоследствии к апоптозу в результате взаимодействия антитела с антигеном CD20 [9-12]. Этот антиген был обнаружен в 1981 году в клетках В-клеточных лимфом и лейкозов [9] и соответственно основное внимание в последующих экспериментальных и клинических исследованиях было сосредоточено на изучении эффективности и механизмов действия ритуксимаба при этих злокачественных процессах.
Полученные в настоящем исследовании данные свидетельствуют о том, что определенной противоопухолевой активностью ритуксимаб обладает при нелимфоидных солидных перевиваемых опухолях, таких как меланома В-16 и аденокарцинома Са-755. Ингибирование роста этих опухолей под действием ритуксимаба достигает 70%.
Каковы возможные объяснения этого феномена?
Во-первых, можно предположить, что чувствительность аденокарциномы Са-755 и меланомы В-16 к ритуксимабу может быть обусловлена экспрессией антигена CD20 в клетках указанных опухолей. Очевидно, что для проверки этого предположения необходимы специальные исследования.
Во-вторых, нельзя исключить существование альтернативного (дополнительного) механизма противоопухолевого действия ритуксимаба, не связанного со спецификой его действия как терапевтического антитела, но вносящего определённый вклад в реализацию противоопухолевого эффекта препарата.
В истории противоопухолевой химиотерапии неоднократно встречались случаи, когда представления о первоначально предполагаемом механизме действия препарата дополнялись или существенно менялись после проведения исследований на новых моделях с применением новых методов, что нередко вело к изменению показаний к применению лекарственного средства [3]. Возможно, что продолжающееся изучение ритуксимаба (в том числе и при неопухолевых заболеваниях) позволит подтвердить или отвергнуть это предположение.
И, наконец, можно предположить, что полученные эффекты связаны с неспецифической иммунологической реакцией на введение чужеродного белка. Ритуксимаб представляет собой химерное моноклональное антитело, в котором 65-70% молекулы представлено человеческим иммуноглобулином, а 30-35%-мышиным. Наблюдаемый в исследовании противоопухолевый эффект можно было бы объяснить исключительно реакцией организма животного-опухоленосителя на человеческий иммуноглобулин. Однако с этим плохо согласуются некоторые факты.
Прежде всего, надо отметить, что у больных неходжкинской лимфомой при введении ритуксимаба в ряде случаев образуются антитела против этого моноклонального антитела (HAMA-антитела), появление которых обусловлено наличием в препарате фрагмента мышиного иммуноглобулина. Однако, это никак не коррелирует с противоопухолевой эффективностью препарата. Более того, появление таких антител снижает эффективность лечения вследствие нейтрализации препарата в результате реакции «антитело-антитело» при повторных введениях препарата [3,7].
Обращает на себя внимание также отмеченная в настоящем исследовании неодинаковая эффективность препарата при разных перевиваемых опухолях, так как можно было ожидать, что неспецифическая противоопухолевая реакция на человеческий иммуноглобулин у мышей в разных экспериментальных группах будет близкой. Вызывает сомнение также возможность достижения столь существенного эффекта (70% торможения роста опухоли) в результате неспецифической иммунологической реакции.
Представляется, что полученные результаты свидетельствуют о перспективности и необходимости более разностороннего изучения препарата ритуксимаб.
Литература
- Барышников А.Ю., Личиницер М.Р., Степанова Е.В. «Новые противоопухолевые препараты на основе моноклональных антител» //Сборник трудов VI Ежегодной российской онкологической конференции. М.., 2002, С.68-69.
- Бейли Н. «Статистические методы в биологии»//М., Изд-во иностранной литературы,1962, С.251.
- Корман Д.Б. «Основы противоопухолевой химиотерапии» //М.., «Практическая медицина», 2006, С.503.
- Островская Л.А., Корман Д.Б., Дементьева Н.П., Фомина М.М., Блюхтерова Н.В. «Препараты класса нитрозоалкилмочевин в отечественной противоопухолевой химиотерапии» //Российский биотерапевтический журнал, 2004, 3, №1, С.24-36.
- Трещалина Е.М., Жукова О.С., Герасимова Г.К., Андронова Н.В., Гарин А.М. «Методические указания по изучению противоопухолевой активности фармакологических веществ» //Книга «Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ» (ред. Р.У.Хабриев), издание 2, М., «Медицина», 2005, С.637-651.
- Boye J., Elter T., Eugert A. “An overview of the current clinical use of the anti-CD20 monoclonal antibody rituximab” //Ann.Oncol., 2003, v.14, P.520-535.
- Сheson B.D., Leonard J.P. “Monoclonal antibody therapy for B-cell Non-Hodghin`s lymphoma” // New Engl.J.Med., 2008, v.359, P.613-626.
- Dalle S., Dumontet C. “Rituximab: mechanism of action and resistance”//Bull. Cancer, 2007, Feb1, 94, #2, P.198-202.
- Nadler L.M., Ritz R., Hardy R. et al. “A unique cell surface antigen identifying lymphoid malignancies of B cell origin” // J.Clin.Inves. 1981, v. 67, P.134-140.
- Pagel J.M., Laugen C., Bonham L., et. al. “Induction of apoptosis using inhibitors of lysophosphatidic acid acyltransferase-beta and anti-CD20 monoclonal antibodies for treatment of human non-Hodgkin’s lymphomas”//Clin. Cancer Res., 2005, 11, #13, P.4857-4866.
- Reff M.E., Carner K., Chambers K.S., et. al. “Depletion of B cells in vivo by a chimeric mouse human monoclonal antibody to CD20” //Blood, 1994, 83, #2, P.435-445.
- Shan D., Ledbetter J.A., Press O.W. “Apoptosis of malignant B cells by ligation CD20 with monoclonal antibodies”//Blood, 1998, v.91., P.1644-1652.
* Работа выполнена при финансовой поддержке проекта «Терапевтические антитела против маркерных белков онкотрансформированных клеток» в рамках Программы фундаментальных исследований Отделения химии и наук о материалах РАН «Биомолекулярная и медицинская химия» (раздел II.3. №10) за 2006-2007 гг. (Координатор Программы – академик Н.С. Зефиров).

